周期表の同じ族に属する元素の性質は類似したものが多く,元素の性質を族ごとにまとめて理解しておくことは大切です.
さて,価電子数が1の原子は1族元素と呼ばれ,周期表では一番左の列に並べて書かれますね.水素$\mrm{H}$以外の1族元素は全て金属であり,アルカリ金属と呼ばれます.
アルカリ金属は反応性に富み,水$\mrm{H_2O}$や空気中の酸素$\mrm{O_2}$などと様々な反応をします.
この記事では,
- アルカリ金属の性質
- アルカリ金属の製法
- アルカリ金属の反応
を順に解説します.
アルカリ金属とは
1族元素は原子量の小さい順に,
| 元素名 | 元素記号 |
|---|---|
| 水素 | $\mrm{H}$ |
| リチウム | $\mrm{Li}$ |
| ナトリウム | $\mrm{Na}$ |
| カリウム | $\mrm{K}$ |
| ルビジウム | $\mrm{Rb}$ |
| セシウム | $\mrm{Cs}$ |
| フランシウム | $\mrm{Fr}$ |
となっています.
また,冒頭でも説明したように,水素$\mrm{H}$以外の6元素$\mrm{Li}$, $\mrm{Na}$, $\mrm{K}$, $\mrm{Rb}$, $\mrm{Cs}$, $\mrm{Fr}$をアルカリ金属といいます.
アルカリ金属のうち,高校化学ではナトリウム$\mrm{Na}$とカリウム$\mrm{K}$がよく扱われ,たまにリチウム$\mrm{Li}$も扱われることがあります.
「1族元素では,なぜ水素だけ金属ではないのか?」といった疑問を持つ人もいるかもしれません.
実はまだ実際に確認されてはいませんが,「水素$\mrm{H_2}$も極めて強い圧力を加えれば金属のような振る舞いをする」という理論があり,例えば木星の中心部などには金属水素が存在するとも言われています.
アルカリ金属の性質
次にアルカリ金属の性質として
- イオン化エネルギー
- 炎色反応
を説明します.
イオン化エネルギー
アルカリ金属は価電子数が1なので,最外殻にある1個の電子を放出して,1価の陽イオンとなります.例えば,
- $\mrm{Na \to Na^+ + e^-}$
- $\mrm{K \to K^+ + e^-}$
- $\mrm{Li \to Li^+ + e^-}$
というわけですね.
しかし,電子は負の電荷を持っているため,正の電荷をもつ原子核に引きつけられています.そのため,電子を原子核から引き剥がそうとしても,タダでは引き剥がせず,ある程度のエネルギーが必要となります.
このときに必要となるエネルギーを第1イオン化エネルギーといいます.
アルカリ金属は価電子数が1なので電子$\mrm{e^-}$を2個以上引き剥がすことはほとんど考えませんが,2族のアルカリ土類金属など価電子数が2以上の金属については2個目の電子を引き剥がすために必要なエネルギーを第2イオン化エネルギーといいます.
炎色反応
例えば,火に食塩$\mrm{NaCl}$をかけると火の色が黄色に変化するのですが,これは食塩$\mrm{NaCl}$に含まれるナトリウム$\mrm{Na}$が火に反応して起こる現象で,このように(アルカリ)金属を火にかざして火の色が変化する現象を炎色反応といいます.
これは高温にさらされることで金属はエネルギーを得るのですが,そのエネルギーが可視光線として放出されることにより火の色が変化するのです.
炎色反応の色は元素によって固有で,アルカリ金属の炎色反応の色は次の通りです.
| 元素 | 炎色反応の色 |
|---|---|
| リチウム$\mrm{Li}$ | 赤 |
| ナトリウム$\mrm{Na}$ | 黄 |
| カリウム$\mrm{K}$ | 赤紫 |
| ルビジウム$\mrm{Rb}$ | 深赤 |
| セシウム$\mrm{Cs}$ | 青紫 |
化学を学ぶ大きな目的の1つとして元素分析があります.
元素分析とは物質を構成する成分を分析することをいい,元素分析のよくある方法としては「水に溶けるか溶けないか」「沈殿を生じるか」などを手がかりにすることがよくあります.
しかし,アルカリ金属の化合物はいずれも水に可溶で沈殿を生じないものが多く,これではアルカリ金属たちの中で識別ができません.
そこで,炎色反応を利用することでどのアルカリ金属が含まれているかを知ることができるので,炎色反応は元素分析の大きな手がかりの1つとなるわけですね.
軽金属
アルカリ金属は軽い金属であり,$\mrm{Li}$, $\mrm{Na}$, $\mrm{K}$はいずれも水より密度が小さいため水に浮きます.
| 元素 | 単体の密度 |
|---|---|
| リチウム$\mrm{Li}$ | $0.53\mrm{g/cm^3}$ |
| ナトリウム$\mrm{Na}$ | $0.97\mrm{g/cm^3}$ |
| カリウム$\mrm{K}$ | $0.86\mrm{g/cm^3}$ |
| ルビジウム$\mrm{Rb}$ | $1.53\mrm{g/cm^3}$ |
| セシウム$\mrm{Cs}$ | $1.87\mrm{g/cm^3}$ |
リチウム$\mrm{Li}$は水の密度半分程度の密度なのは少し驚きですね.
温度によって少し変わりますが,水の密度は約$1\mrm{g/cm^3}$ですね.
なお,金属中で最も密度の小さい金属はリチウム$\mrm{Li}$で,1番目に密度の小さい金属はカリウム$\mrm{K}$です.
一般に密度が$4\mrm{g/cm^3}$〜$5\mrm{g/cm^3}$以下の金属を軽金属というため,アルカリ金属はいずれも軽金属です.
なお,アルカリ金属以外の軽金属としては,アルミニウム$\mrm{Al}$($2.70\mrm{g/cm^3}$),マグネシウム$\mrm{Mg}$($1.74\mrm{g/cm^3}$),チタン$\mrm{Ti}$($4.50\mrm{g/cm^3}$)などがあります.
アルカリ金属の製法
アルカリ金属の単体は「アルカリ金属の塩化物の融解塩電解」によって得られます.
「塩化物」とは塩化ナトリウム$\mrm{NaCl}$のように塩素$\mrm{Cl}$が結合した化合物を指し,「融解塩電解」とはその名の通り「融解した(溶けた)塩を電気分解すること」を言います.
電気分解は電解ともいいますね.
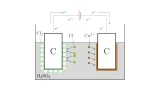
水$\mrm{H_2O}$に電流を流すと,陽極付近に$\mrm{OH^-}$が偏り,陰極付近に$\mrm{H^+}$が偏ることで,酸素$\mrm{O_2}$と水素$\mrm{H_2}$に電気分解されますね.
このように,アルカリ金属の塩化物をガンガンに熱して液体にしたものに電極を差し込んで電気分解することでアルカリ金属を得ることができます.
塩化ナトリウム$\mrm{NaCl}$の場合は約800°Cにまで熱することで,塩化ナトリウム$\mrm{NaCl}$は溶けて液体になります.
そこで,融解した塩化ナトリウム$\mrm{NaCl}$は電気を通せば,陽極付近に$\mrm{Cl^-}$が偏り,陰極付近に$\mrm{Na^+}$が偏ることで,塩素$\mrm{Cl_2}$とナトリウム$\mrm{Na}$に電気分解されるというわけですね.
なお,実験室で融解塩電解を行う場合はガスバーナーを複数個使って加熱しますから,かなり激しい加熱です.ほとんどの化学の資料集には融解塩電解の写真が載っていると思うので,一度確認してみてください.
アルカリ金属の反応
アルカリ金属の反応性は非常に大きく
- 空気中の酸素$\mrm{O_2}$
- 水$\mrm{H_2O}$
と反応します.
空気酸化
アルカリ金属は反応性が高く,乾燥した空気中にアルカリ金属を放置するだけで表面はすぐに酸化します.例えば,
の化学反応が空気中で起こります.
アルカリ金属は柔らかいためカッターなどで切断することができるのですが,例えばナトリウムを切断した瞬間の切断面は酸化していないため金属光沢があります.
しかし,直ぐに空気酸化してナトリウム$\mrm{Na}$の金属光沢は失われ,酸化ナトリウム$\mrm{Na_2O}$は白色に変化していく様子が観察できます.
水との反応
アルカリ金属は常温の水とも反応し,水素$\mrm{H_2}$を発生して水酸化物になります.例えば,
の化学反応が起こります.
なお,上の3つのいずれの反応も発熱反応なのですが,反応熱は
$\mrm{\text{カリウム}K>\text{ナトリウム}Na>\text{リチウム}Li}$
となっています.
ちなみに,水$\mrm{H_2}$にナトリウム$\mrm{Na}$を投げ込むと爆発するのですが,これは
- 化学反応で水素$\mrm{H_2}$が生じる
- 水素$\mrm{H_2}$が燃焼する程度に反応熱がある
ことが理由です
YouTubeなどで検索すると,ナトリウム$\mrm{Na}$の爆発映像はたくさんヒットします.
ナトリウム$\mrm{Na}$と水$\mrm{H_2O}$の反応について,化学工場が火災になって消防車が放水したところ,水とナトリウム$\mrm{Na}$と反応して爆発したという事故があったります.
ただし,リチウム$\mrm{Li}$の反応熱はそれほど大きくないため,発生した水素$\mrm{H_2}$と空気中の酸素$\mrm{O_2}$を燃焼させるだけの熱量を生み出せず爆発には至らないことが多いです.
保存方法
以上のようにアルカリ金属は非常に反応性に富むため,保存方法には気をつける必要があり,アルカリ金属は石油中または灯油中に保存します.
石油中に保存していれば,水とも空気中の酸素とも反応することはありません.
このアルカリ金属の保存方法とよく間違えられるのが,黄リン$\mrm{S}$の保存方法です.黄リン$\mrm{S}$は空気中で自然発火することがあるので,水中保存することになります.
理由を知っていればこれらを混同することはありませんね.
アルカリ金属を水中に保存しても,黄リンを灯油中に保存しても大惨事になりますね笑


コメント