前回までの記事では,ボルタ電池,ダニエル電池,鉛蓄電池といった化学電池の仕組みを説明してきました.
この記事からは電気分解を扱っていきますが,最初は電池と電気分解の違いがなかなか分かりにくく混乱してしまいがちです.
化学電池は「化学変化を起こして,物質から電気エネルギーを取り出す装置」を指す一方で,電気分解はこれと逆に「電気エネルギーを使って起こる分解(化学変化)」を指します.
つまり,
- 化学電池は自動的な反応
- 電気分解は受動的な反応
ということができます.
この記事で電気分解を理解して,電池と電気分解をはっきり区別して考えられるようにしてください.
「電池と電気分解」の一連の記事
そもそも電気分解とは
例えば,炭酸水素ナトリウム$\mrm{NaHCO_3}$を加熱すると,次の反応が起こります.
これは加熱したことによる熱エネルギーで$\mrm{2NaHCO_3}$が$\mrm{Na_2CO_3}$, $\mrm{H_2O}$, $\mrm{CO_2}$に分解されており,このように熱エネルギーを与えることによって起こる分解を熱分解といいますね.
電気分解の具体例
一方,熱エネルギーではなくビリビリと電気エネルギーを与えることによって起こる分解を電気分解または電解といいます.
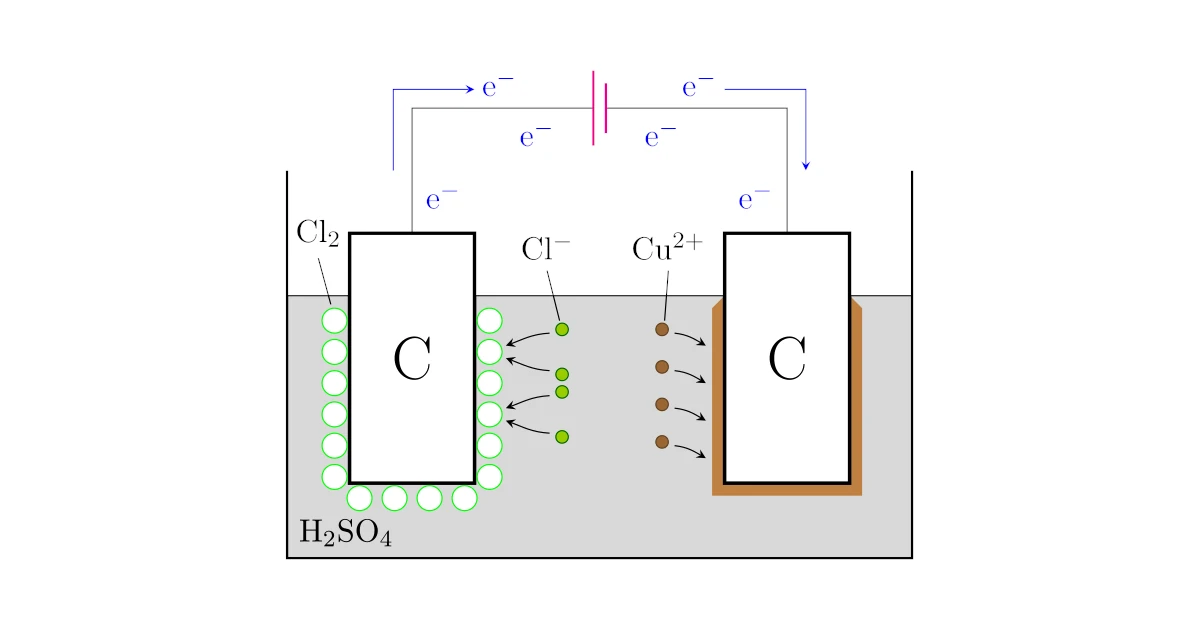
例えば,2本の炭素棒を塩化銅(II)水溶液$\mrm{CuCl_2}aq$にボチャンと浸けて電気を流すことで,塩化銅(II)水溶液$\mrm{CuCl2}aq$が電気分解されます.
炭素棒とは鉛筆の芯を太くしたような黒鉛$\mrm{C}$の塊のことです.
の反応が起こり,電池の負極が繋がっている方の炭素棒では
の反応が起こります.
これら2つの半反応式を併せると
となって,硫酸銅(II)水溶液$\mrm{CuCl_2}aq$が銅$\mrm{Cu}$と塩素$\mrm{Cl}$に分解されていることが分かりますね.
他にもアルカリ金属(ナトリウム$\mrm{Na}$やカリウム$\mrm{K}$など)を生成するときにも電気分解を用います.
アルカリ金属の塩化物($\mrm{NaCl}$や$\mrm{KCl}$など)を加熱して融解させ,電気分解を用いることでアルカリ金属を生成します.
このアルカリ金属を得る電気分解を融解塩電解といいます.
電気分解の仕組み
電気分解は溶液に2本の炭素棒などをボチャンと浸け,炭素棒と電池を下図のように繋いで電流を流すことで起こります.
炭素棒ではない電極を用いることもありますが,最初からそこまで説明すると複雑になるので炭素棒ではない電極については次の記事で説明します.
そもそも電流とは「電子$\mrm{e^-}$の流れ」のことをいい,電池の電極のうち
というのでした.このため,電気分解の電極のうち
- 「電池の正極と繋がった方の電極」は電子を放出する
- 「電池の負極と繋がった方の電極」は電子を受け取る
ということになり,この電気分解の極を次のように言います.
電気分解において
- 「電池の正極とつながっている方の電極」を陽極
- 「電池の負極とつながっている方の電極」を陰極
という(陽極は下図の$+$側の電極,陽極は下図の$-$側の電極).
陽極は電子を放出するので酸化反応が,陰極は電子を受け取るので還元反応が起こりますね.
確かに先ほど上で挙げた塩化銅(II)水溶液$\mrm{CuCl_2}aq$の電気分解も
- 陽極で酸化反応$\mrm{2Cl^- \to Cl + 2e^-}$
- 陰極で還元反応$\mrm{Cu^{2+} + 2e^- \to Cu}$
が起こっていますね.
電池と電気分解の3つの違い
さて,電気分解の説明が終わったので,本題に移ります.電池と電気分解には,大まかに次の3つの違いがあります.
どれも本質的に同じことですが,どの考え方でも当たり前にしておきたいので分けて説明します.
自動的反応・受動的反応の違い
そもそも化学電池とはイオン化傾向の差を利用して電子$\mrm{e^-}$の移動(つまり電流)を生み出す装置であることは,前回までの記事でも説明してきた通りですね.
つまり,電池は組み立てれば自然と電流が流れるわけから,電池は「自動的反応」ということができます.
一方,電極が炭素棒$\mrm{C}$の電気分解では,電極$\mrm{C}$がイオン化するということがそもそもあり得ません.
そのため,電気分解の装置だけで勝手に電気分解が進むことはありません.
つまり,電気分解は電池に繋ぐことで電流が流れて反応が引き起こされるわけですから,電気分解は「受動的反応」ということができます.
すなわち,「電池が電流を流す→電気分解の反応が引き起こされる」という順で反応が起こるわけですね.
正極・陽極(負極・陰極)の違い
正も陽も「プラス」,負も陰も「マイナス」なのでややこしいのですが,
- 正極と負極は電池の極
- 陽極と陰極は電気分解の極
です.イオン化傾向が大きい金属は陽イオンになりやすく,陽イオンになるということはマイナスの電荷を持つ電子$\mrm{e^-}$を放出するということですね.
一方,先ほど定義したように陰極は「電気分解において電池の負極と繋がった方の電極」のことをいうのでしたから,負極と陰極をそれぞれ説明すると次のようになりますね.
- 負極:電池の電極の金属でイオン化傾向の大きい方
- 陰極:電気分解の電極で電池の負極とつながっている方
また,電池でイオン化傾向の小さい方の電極は電子$\mrm{e^-}$を受け取る正極になります.
一方,陽極は「電気分解において電池の正極と繋がった方の電極」のことをいうのでしたから,正極と陽極をそれぞれ説明すると次のようになりますね.
- 正極:電池の電極の金属でイオン化傾向の小さい方
- 陽極:電気分解の電極で電池の正極とつながっている方
先ほどの「電池は自動的反応で,電気分解は受動的反応」という説明と併せると,「先に電池の正極と負極が決まり,そこから電気分解の陽極と陰極が決まる」という流れがみてとれますね.
酸化・還元の違い
結論から書けば「正極は還元反応,陽極は酸化反応」ですが,これは酸化還元反応の基本に立ち戻って考えれば簡単に分かります.
- 還元反応:電子$\mrm{e^-}$を受け取る
- 酸化反応:電子$\mrm{e^-}$を放出する
でした.また,
- 電池の極のうち電子$\mrm{e^-}$を受け取る方が正極
- 電気分解の極のうち電子$\mrm{e^-}$を放出する方が陽極
なのでした.よって,
- 正極 → 電子$\mrm{e^-}$を受け取る → 還元される
- 陽極 → 電子$\mrm{e^-}$を放出する → 酸化される
ということになりますね.また,同様に「負極は酸化反応,陰極は還元反応」となることが分かりますね.
| 電池/電気分解 | 酸化/還元 | |
|---|---|---|
| 正極 | 電池 | 還元 |
| 負極 | 電池 | 酸化 |
| 陽極 | 電気分解 | 酸化 |
| 陰極 | 電気分解 | 還元 |
慣れるまではパッと答えられないかもしれませんが,大切なところなので電池の仕組み・電気分解の仕組みをきちんと理解して,はっきり区別できるようにしてください.

コメント