例えば屋外に放置された鉄はどんどん錆びていきますが,この「鉄が錆びる」という現象を化学では「鉄が酸化される」と表現します.
また,錆びた鉄にうまく化学的処理を施せば錆びる前の鉄に戻すこともでき,この酸化の逆の現象を化学では還元といいます.
この対になっている化学反応である酸化と還元は鉄以外の物質でも起こります.
例えば,銅を素材とする古い10円硬貨が黒くなっていくのも酸化ですし,酸化と還元は金属以外でも起こります.
このように酸化還元反応は身の回りに溢れた身近な化学反応ということができます.
酸化還元反応はこの次に学ぶ「電池と電気分解」の分野の基礎にもなっており,私たちが普段からお世話になっている電池も原理は酸化還元反応です.
この記事では
- 酸化・還元とは何か?
- 酸化と還元の関係
を順に説明します.
「酸化還元反応」の一連の記事
酸化・還元とは何か?
酸化という言葉にある「酸」は酸素$\mrm{O}$のことで,基本的なイメージとしては酸素$\mrm{O}$と結びつく化学反応を指します.
また,還元はこの逆で酸素$\mrm{O}$が分離される化学反応を指します.
しかし,実際にはより広い反応を酸化還元反応というので,ここではまず酸化と還元の定義を説明します.
酸化の具体例と考え方
例えば,銅$\mrm{Cu}$が錆びるというのは,酸素$\mrm{O_2}$と
という化学反応が起こり,酸化銅(II)$\mrm{CuO}$ができることをいいます.
実はこの銅$\mrm{Cu}$が錆びる化学反応は次の2つに分けて考えることができます.
ここで$\mrm{e^-}$は電子で,このような電子$\mrm{e^-}$を含んだ式を半反応式といいます.
半反応式については次の記事で詳しく解説します.
半反応式$(1)$では銅$\mrm{Cu}$が銅イオン$\mrm{Cu^{2+}}$と電子$\mrm{e^-}$に分かれ,半反応式$(2)$では酸素$\mrm{O_2}$が電子$\mrm{e^-}$を受け取り酸素イオン$\mrm{O^{2-}}$になっていますね.
つまり,上の化学反応は「銅$\mrm{Cu}$が電子$\mrm{e^-}$を相手に渡すことで起こる化学反応式」ということができます.
そこで一般に酸化は次のように定義されます.
物質$\mrm{X}$が電子$\mrm{e^-}$を放出するとき「$\mrm{X}$は酸化される」という.
冒頭で触れた酸化は酸素$\mrm{O}$と結合する反応のことでしたが,一般には電子$\mrm{e^-}$を放出するときに酸化されると言うわけですね.
還元の具体例と考え方
例えば,錆びた酸化銅(II)$\mrm{CuO}$に高温の水素$\mrm{H_2}$を吹きつけると
という化学反応が起こり,もとの銅$\mrm{Cu}$に戻ります.
実は錆びた酸化銅(II)$\mrm{CuO}$が元に戻る化学反応は次の2つに分けて考えることができます.
先ほどの酸化とは逆に,半反応式$(3)$では酸化銅(II)$\mrm{CuO}$が電子$\mrm{e^-}$を受け取り,半反応式$(4)$では水素$\mrm{O_2}$が電子$\mrm{e^-}$を放出し水素$\mrm{H}^+$イオンになっていますね.
つまり,上の化学反応は「酸化銅(II)$\mrm{CuO}$が電子$\mrm{e^-}$を相手から受け取ることで起こる化学反応式」ということができます.
そこで酸化とは逆に還元は次のように定義されます.
物質$\mrm{X}$が電子$\mrm{e^-}$を受け取るとき「$\mrm{X}$は還元される」という.
冒頭で触れた還元は酸素$\mrm{O}$と分かれる反応のことでしたが,一般には電子$\mrm{e^-}$を放出するときに酸化されると言うわけですね.
酸化と還元の関係
次に酸化と還元の関係を説明します.
具体例(塩素$\mrm{Cl_2}$と水素$\mrm{H_2}$)
塩素$\mrm{Cl_2}$と水素$\mrm{H_2}$が化合すると
という反応が起こりますが,この反応は
と半反応式に分けることができます.
半反応式$(5)$を見ると,塩素$\mrm{Cl_2}$は電子$\mrm{e^-}$を受け取っているので,塩素$\mrm{Cl_2}$は還元されたということができますね.
一方,半反応式$(6)$は水素$\mrm{H_2}$が電子$\mrm{e^-}$を放出しているので,水素$\mrm{H_2}$は酸化されたということができますね.
酸化と還元の同時性
このように,一般に化学反応で酸化される物質がある場合には同時に還元される物質もあることになりますね.逆に還元される物質があれば,酸化される物質もありますね.
つまり,次の事実が成り立ちます.
酸化と還元は必ず同時に起こる.
このことから,酸化と還元の起こる反応を酸化還元反応といいます.
また,電子$\mrm{e^-}$の受け渡しによって酸化と還元を定義しましたが,次の表も当たり前にしておきましょう.
| 電子 | 酸素 | 水素 | |
| 酸化される | 放出する | 受け取る | 放出する |
| 還元される | 受け取る | 放出する | 受け取る |
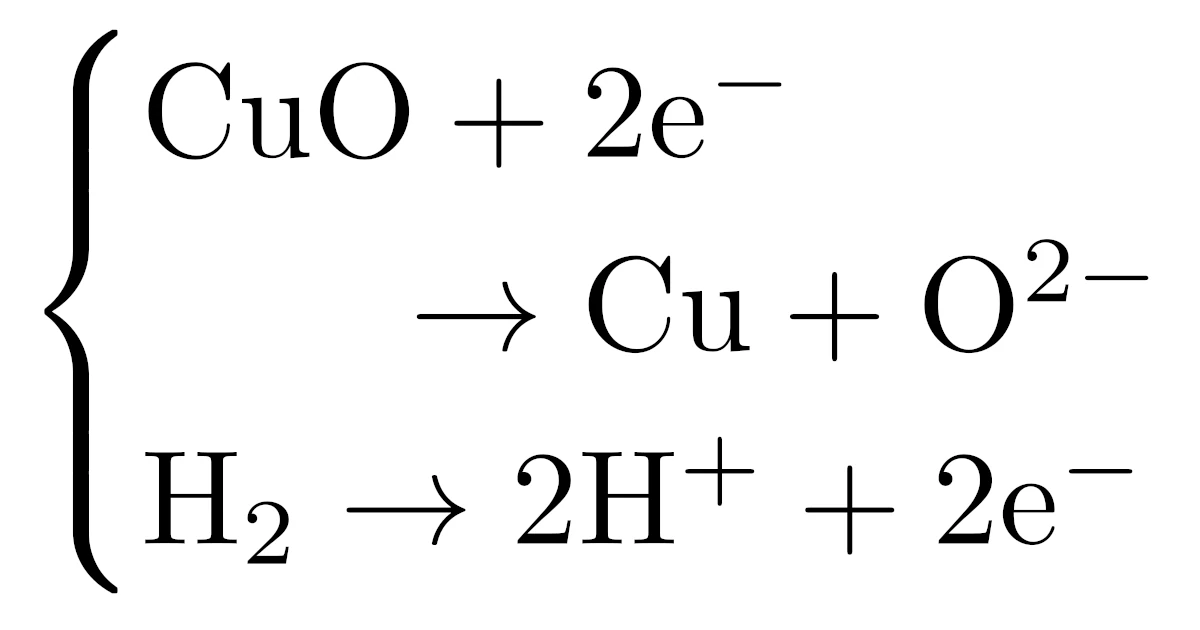

コメント