例えば,過酸化水素$\mrm{H_2O_2}$の半反応式を考えるとき,溶液が酸性の場合には
の半反応式が起こり,溶液が中性または塩基性の場合には
の半反応式が起こります.
このように,同じ物質でも溶液が酸性のときと中性・塩基性のときで,半反応式が異なっているものがあります.
その典型的なものとして
- 過酸化水素$\mrm{H_2O_2}$
- 過マンガン酸カリウム$\mrm{KMnO_4}$
があります.
この記事では
- 酸性条件と中性・塩基性条件で半反応式が変わる理由
- 酸性条件と中性・塩基性条件の具体例
を順に説明します.
「酸化還元反応」の一連の記事
酸性条件と中性・塩基性条件で半反応式が変わる理由
前回の記事で酸化剤・還元剤の半反応式を一覧で紹介しましたが,この記事でも
- 過酸化水素$\mrm{H_2O_2}$
- 過マンガン酸カリウム$\mrm{KMnO_4}$
の半反応式を見てみましょう.
| 物質/化学式(条件) | 半反応式 |
|---|---|
| 過酸化水素$\mrm{H_2O_2}$ (酸性) |
|
| 過酸化水素$\mrm{H_2O_2}$ (中性・塩基性) |
|
| 過マンガン酸カリウム$\mrm{KMnO_4}$ (酸性) |
|
| 過マンガン酸カリウム$\mrm{KMnO_4}$ (中性・塩基性) |
|
この表から明らかなように,過酸化水素$\mrm{H_2O_2}$や過マンガン酸カリウム$\mrm{KMnO_4}$は「酸性」のときと,「中性・塩基性」ときで半反応式が変わっていますね.
酸性条件
化学反応の中には,硫酸$\mrm{H_2SO_4}$などの酸性溶液中で考えるものがあります.
酸性溶液中には水素イオン$\mrm{H^+}$が多く含まれているため,酸性溶液中の化学反応では水素イオン$\mrm{H^+}$をたくさん与えることができます.
実際,酸性条件下の過酸化水素$\mrm{H_2O_2}$, 過マンガン酸カリウム$\mrm{KMnO_4}$の半反応式はそれぞれ
であり,確かに左辺に水素イオン$\mrm{H^+}$が与えられていますね.
このように「水素イオン$\mrm{H^+}$の多い酸性溶液中で考える」というのが酸性条件の意味です.
中性・塩基性条件
一方で,中性溶液中や塩基性溶液中で化学反応を考えることもあります.
中性溶液中,塩基性溶液中には水素イオン$\mrm{H^+}$は微量しか含まれていいないため,酸性溶液中のように水素イオン$\mrm{H^+}$を与えることができません.
実際,酸性条件下の過酸化水素$\mrm{H_2O_2}$, 過マンガン酸カリウム$\mrm{KMnO_4}$の半反応式はそれぞれ
であり,確かに左辺に水素イオン$\mrm{H^+}$はありませんね.
このように「水素イオン$\mrm{H^+}$の少ない中性・塩基性溶液中で考える」というのが中性・塩基性条件の意味です.
酸性条件と中性・塩基性条件の具体例
それでは具体例を考えてみましょう.
酸性条件下での半反応式
問題に「硫酸酸性下」などと書いてあると,「硫酸を使わないといけないのかな?」と思ってしまいそうですが,「酸化還元反応自体」に硫酸は関係しません.
しかし,硫酸が存在することにより溶液は酸性となるため,この問題では酸性条件下での過マンガン酸カリウム$\mrm{KMnO_4}$の半反応式を使うわけですね.
大切なことは「硫酸酸性」という条件は「半反応式の左辺で水素イオン$\mrm{H^+}$を使え」というヒントになっていることです.
なお,硫酸が「水素イオン$\mrm{H^+}$を強く押し付ける性質」を持つことは当たり前にしておいてください.
中性・塩基性条件下での半反応式
中性条件の過酸化水素水にヨウ化カリウム水溶液を加えると,それぞれどのような半反応式に従うか?
溶液が中性なので,この問題では中性・塩基性条件下での過酸化水素$\mrm{H_2O_2}$の半反応式を使うわけですね.
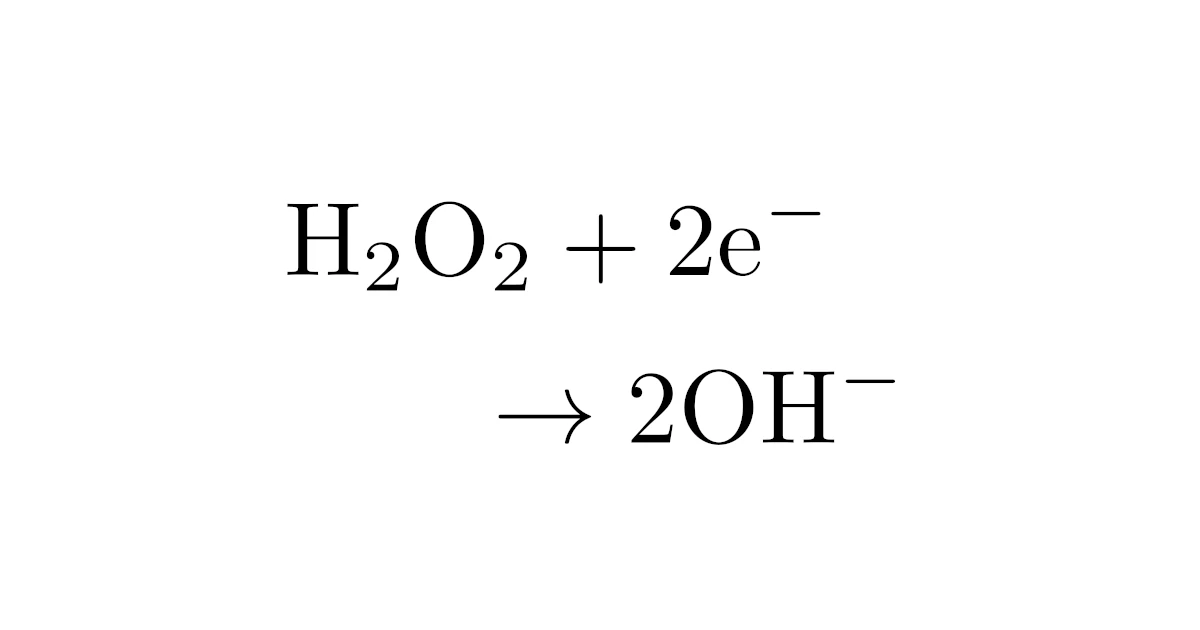

コメント