ボルタ電池とダニエル電池は反応が終われば使えなくなる「使い切りの電池」なのでした.
しかし,それではあまり使い勝手が良くないため,再び使うことができる電池(つまり,充電ができる電池)が欲しいところです.実は
- 充電ができない電池を一次電池
- 充電ができる電池を二次電池
というのですが,重要な二次電池として鉛蓄電池があります.
鉛蓄電池は車のバッテリーとして利用されるなど,現代社会ではなくてはならない非常に実用性の高い電池で,高校化学でも頻出です.
鉛蓄電池の嬉しいところは汎用性が高いにも関わらず,その仕組み自体がシンプルなところにあります.
この記事では
- 鉛蓄電池の仕組み
- 鉛蓄電池の放電と充電
を順に解説します.
「電池と電気分解」の一連の記事
鉛蓄電池の仕組み
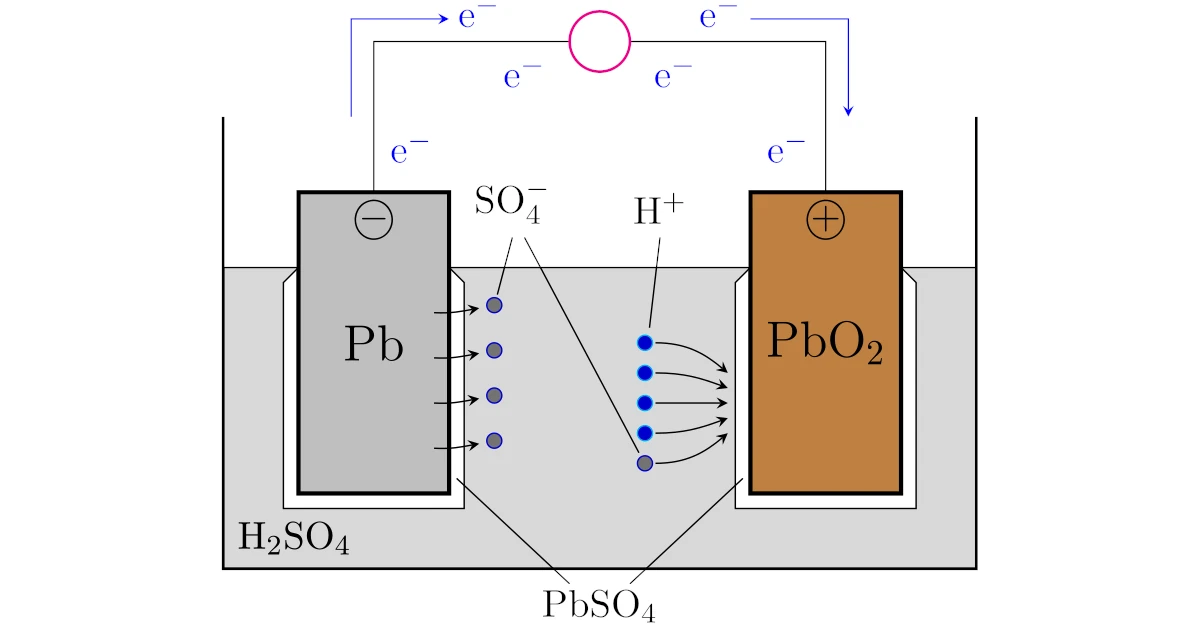
鉛蓄電池は希硫酸$\mrm{H_2SO_4}$に鉛$\mrm{Pb}$と二酸化鉛$\mrm{PbO_2}$を浸け,導線でつなげば完成です.
図の導線の途中にある〇は抵抗で,たとえば豆電球だと思えばイメージとしては十分です.
鉛蓄電池では鉛$\mrm{Pb}$と二酸化鉛$\mrm{PbO_2}$のどちらが正極でどちらが負極になるでしょうか?
化学電池は「酸化還元反応を利用して電子を取り出す装置」でしたから,鉛$\mrm{Pb}$と二酸化鉛$\mrm{PbO_2}$のどちらかは酸化され,どちらかは還元されるはずです.
こう考えると,すでに酸化している二酸化鉛$\mrm{PbO_2}$よりも,酸化していない鉛$\mrm{Pb}$の方が酸化しやすそうです.
このことから,鉛$\mrm{Pb}$は酸化されて
の半反応式が起こります.一方,酸化鉛$\mrm{PbO_2}$は還元されて
の半反応式が起こります.
このように,電子は鉛$\mrm{Pb}$電極から二酸化鉛$\mrm{PbO_2}$電極へ移動するので,
- 鉛$\mrm{Pb}$が負極
- 二酸化鉛$\mrm{PbO_2}$が正極
と分かります.
以上より,鉛蓄電池の電池式は以下のようになりますね.
鉛蓄電池の放電と充電
一般に化学電池の反応が進むことを放電と言い,化学電池の反応が逆に進み元の使える状態に戻ることを充電といいます.
放電の化学反応式
鉛蓄電池で起こる2つの半反応
の辺々を加えると,電子$\mrm{e^-}$が打ち消されて
となりますね.
さらに左辺で2個の水素イオン$\mrm{H^+}$と1個の硫酸イオン$\mrm{SO4^{2-}}$で硫酸$\mrm{H_2SO_4}$とできるので,
が放電の化学反応式です.
鉛蓄電池の化学反応式
鉛蓄電池の大きな特徴は充電ができることです.
最近は充電式乾電池も広く普及していますが,日常的に目にする多くの乾電池は充電できないことも多いですね.これらのように
- 充電できない電池を一次電池
- 充電できる電池を二次電池
といいます.
鉛蓄電池は充電ができるので二次電池で,一方のボルタ電池やダニエル電池は充電ができないので一次電池ですね.
さて,鉛蓄電池の充電の方法は非常に簡単で,鉛蓄電池を放電とは逆向きに電流が流れるように別の電源(電池)を繋ぐだけでOKです.
これにより,負極表面の硫酸鉛$\mrm{PbSO_4}$が鉛$\mrm{Pb}$に戻り,正極表面の硫酸鉛$\mrm{PbSO_4}$が酸化鉛$\mrm{PbO_2}$に戻ります.
充電の化学反応式は放電と全く逆で
となります.
電極の色
鉛蓄電池は放電と充電で電極の色が変化するため,その色を問われることも多いです.
鉛蓄電池で登場する3つの物質(鉛$\mrm{Pb}$,酸化鉛$\mrm{PbO_2}$,硫酸鉛$\mrm{PbSO_4}$)について,色は
- 鉛$\mrm{Pb}$は灰色
- 酸化鉛$\mrm{PbO_2}$は褐色
- 硫酸鉛$\mrm{PbSO_4}$は白色
となっています.
このため,放電前の正極は酸化鉛$\mrm{PbO_2}$の褐色で,負極は鉛$\mrm{Pb}$の灰色となっています.
そこから放電すると正極でも負極でも硫酸鉛$\mrm{PbSO_4}$が析出して徐々に白色になります.
逆に放電した鉛蓄電池を充電すると硫酸鉛$\mrm{PbSO_4}$が溶け出して,正極は本来の酸化鉛$\mrm{PbO_2}$の褐色,負極は鉛$\mrm{Pb}$の灰色に戻ります.

コメント