酸化剤と還元剤の2つの物質が与えられたとき,この2つの物質によって起こる酸化還元反応の化学反応はどのように導けばよいでしょうか?
結論から言えば,酸化剤・還元剤の半反応式は式中に電子$\mrm{e^-}$やイオンを含むため,
- 電子$\mrm{e^-}$を消去するステップ
- イオンを消去するステップ
の2つのステップで酸化還元反応の化学反応式を導くことになります.
この記事では,具体例をもとに半反応式から化学反応式を導く方法を説明します.
「酸化還元反応」の一連の記事
電子を式から消去するステップ
半反応式から酸化還元反応の化学反応式を導く際に最初にやることは,電子$\mrm{e^-}$を式から消去することです.
連立1次方程式の消去法の要領で電子を消去します.
例1(熱濃硫酸とシュウ酸)
熱濃硫酸$\mrm{H_2SO_4}$とシュウ酸$\mrm{(COOH)_2}$の化学反応式を求めよ.
熱濃硫酸$\mrm{H_2SO_4}$は酸化剤,シュウ酸$\mrm{(COOH)_2}$は還元剤ですね.
熱濃硫酸$\mrm{H_2SO_4}$の半反応式は
シュウ酸$\mrm{(COOH)_2}$の半反応式は
です.電子$\mrm{e^-}$の係数は(1)と(2)で等しいので,両辺をそのまま足すと電子$\mrm{e^-}$が消えますね.
これで,酸化還元反応式
が得られました.
例2(二酸化硫黄と硫化水素)
二酸化硫黄$\mrm{SO_2}$と硫化水素$\mrm{H_2S}$の酸化還元反応の化学反応式を求めよ.
二酸化硫黄$\mrm{SO_2}$は相手によって酸化剤にも還元剤にもなりますが,硫化水素$\mrm{H_2S}$は還元剤なので二酸化硫黄$\mrm{SO_2}$は酸化剤としてはたらきます.
二酸化硫黄$\mrm{SO_2}$の半反応式は
硫化水素$\mrm{H_2S}$の半反応式は
です.電子$\mrm{e^-}$の係数は(1)は4で(2)は2と異なります.この場合は$(1)+2\times(2)$を考えると電子$\mrm{e^-}$が消えそうです.
これで,酸化還元反応式
が得られました.
両辺を足したとき
- (1)の左辺の水素イオン$\mrm{4H^+}$
- (2)の右辺の水素イオン$\mrm{2H^+}$
も一緒に消えていることに注意してください.
イオンを式から消去するステップ
上の2つの例では,半反応式から電子$\mrm{e^-}$を消去した後の式にはイオンは残りませんでしたが,場合によっては式中にイオンが残ります.
この場合には,もとから存在するイオンと併せることにより,イオンを処理できて酸化還元反応の化学反応式が導けます.
例3(希硝酸と二酸化硫黄)
希硝酸$\mrm{HNO_3}$と二酸化硫黄$\mrm{SO_2}$の酸化還元反応の化学反応式を求めよ.
希硝酸$\mrm{HNO_3}$の半反応式は
二酸化硫黄$\mrm{SO_2}$の半反応式は
です.$2\times(1)+3\times(2)$を考えると電子$\mrm{e^-}$が消えて
とイオン反応式
が得られました.
しかし,反応後の右辺には硫酸イオン$\mrm{SO_4^{2-}}$と水素イオン$\mrm{H^+}$が残っています.
イオンが含まれていては化学反応式と呼べないので,これらのイオンを消す必要があります.
いま,硫酸イオン$\mrm{SO_4^{2-}}$と水素イオン$\mrm{H^+}$を合わせて硫酸$\mrm{H_2SO_4}$ができるので,
が求める酸化還元反応式です.
例4(硫酸条件下の過マンガン酸カリウムと硫化水素)
硫酸酸性下での過マンガン酸カリウム$\mrm{KMnO_4}$と硫化水素$\mrm{H_2S}$の酸化還元反応の化学反応式を求めよ.
硫酸酸性下での過マンガン酸カリウム$\mrm{KMnO_4}$の半反応式は
硫化水素$\mrm{H_2S}$の半反応式は
です.$2\times(1)+5\times(2)$を考えると電子$\mrm{e^-}$が消えて
とイオン反応式
が得られました.
例3はこの時点で式中のイオン達が上手くまとまってくれましたが,今回はそう上手くいかずこれらを消さなければなりません.
そこで,もともとは過マンガン酸カリウム$\mrm{KMnO_4}$が反応していることを思い出すと,溶液中にはカリウムイオン$\mrm{K^+}$が存在しているはずです.
カリウムイオン$\mrm{K^+}$を2個ずつ両辺に加えると
となりますね.
さらに今は硫酸酸性下での反応なので,溶液中には硫酸イオン$\mrm{SO_4^{2-}}$も存在しています.そこで,両辺に硫酸イオン$\mrm{SO_4^{2-}}$を3個加えれば
と求める酸化還元反応が得られました.
半反応式では直接的に出てこなかった硫酸イオン$\mrm{SO_4^{2-}}$ですが,反応式ではこのように必要になります.
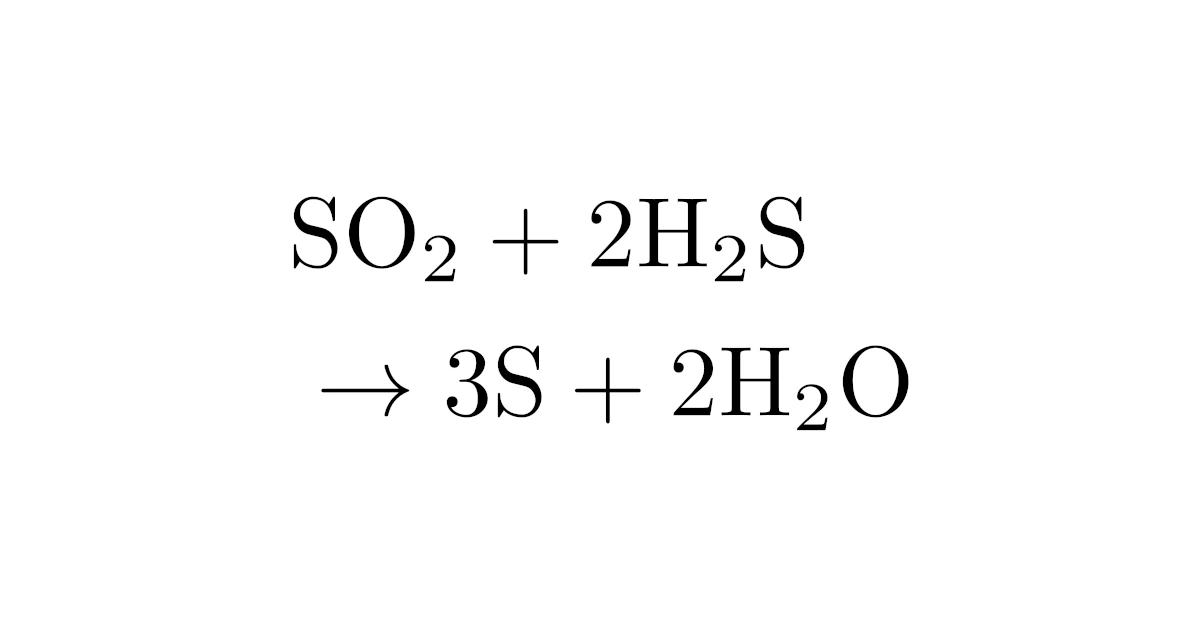

コメント