高校化学で特に重要な工業的製法は5つあります.
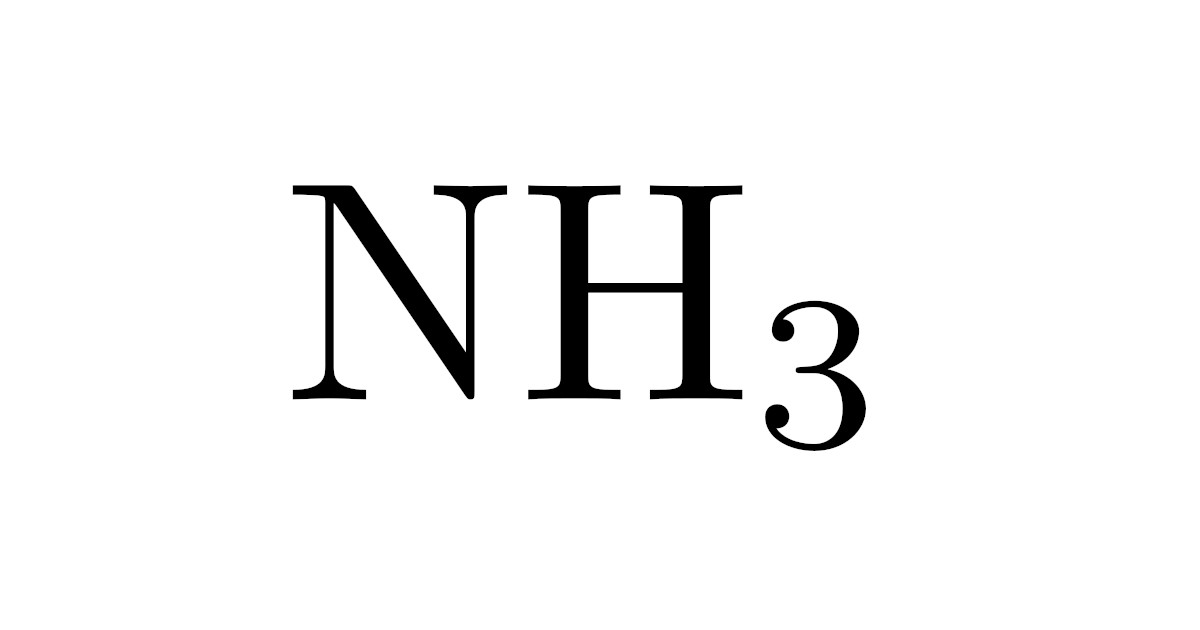
そのうちの1つであるハーバー・ボッシュ法はアンモニア$\mrm{NH_3}$の製法で,水素$\mrm{H_2}$と窒素$\mrm{N_2}$を化合させるだけという非常にシンプルなものです.
ハーバー・ボッシュ法の反応の本質にはルシャトリエの原理が深く関わっているため,ハーバー・ボッシュ法はルシャトリエの原理を通して理解することが大切です.
この記事では
- ハーバー・ボッシュ法の反応
- ルシャトリエの原理
を順に説明しています.
ガスバーナー程度しか使わない「実験室的製法」に対して,「工業的製法」はビジネス用の製法で利益の上がるように物質を作るのが目標です.そのため「無駄なく,安くを目指した製法」となっており,ガンガン圧力をかけたり,高温にすることができるのも特徴です.
「工業的製法」の一連の記事
ハーバー・ボッシュ法の反応
ハーバー・ボッシュ法で必要なものは
- 水素$\mrm{H_2}$
- 窒素$\mrm{N_2}$
- 四酸化三鉄$\mrm{Fe_3O_4}$(触媒)
です.また,反応は非常にシンプルで
となっています.単純に水素$\mrm{H_2}$と窒素$\mrm{N_2}$を無理やりくっつけ,アンモニア$\mrm{NH_3}$を作ろうという発想ですね.
四酸化三鉄$\mrm{Fe_3O_4}$は触媒なので反応を促進するためにあるだけで,化学反応の中には登場しません.
しかし,実際に水素$\mrm{H_2}$と窒素$\mrm{N_2}$を混ぜるだけではこの反応は起こりません.
そこで水素と$\mrm{H_2}$と窒素$\mrm{N_2}$を高圧にして力づくで反応させるという方法をとります.
この反応を進めるために大切なのが次で説明するルシャトリエの原理です.
ルシャトリエの原理とハーバー・ボッシュ法
それではルシャトリエの原理とハーバー・ボッシュ法の関係を説明します.
ルシャトリエの原理
[ルシャトリエの原理]可逆反応が平衡状態にあるとき,外部から平衡を支配する条件(温度,圧力,濃度)を変えると,その影響を緩和する方向へ平衡が移動し,新しい平衡状態となる.
要するに
- 温度が上がると温度を下げる(温度が下がると温度を上げる)向きに反応が進む
- 圧力が上がると圧力を下げる(圧力が下がると圧力を上げる)向きに反応が進む
- 濃度が上がると濃度を下げる(濃度が下がると濃度を上げる)向きに反応が進む
というように,起こった変化と逆の変化を起こして元に戻そうとする原理のことをルシャトリエの原理といいます.
さて,ハーバー・ボッシュ法では反応
が右に進むようにしたいわけですが,どのように圧力と温度を変化させれば反応が進むようにできるでしょうか?
ハーバー・ボッシュ法の圧力・温度
ハーバー・ボッシュ法の反応
において,左辺は窒素$\mrm{N_2}$が3個,水素$\mrm{H_2}$が1個の合わせて4個です.一方,右辺はアンモニア$\mrm{NH_3}$が2個です.
一般に分子の個数が少ない方が分子がぶつかる回数が多くなり圧力が大きくなりますから,ハーバー・ボッシュ法では反応が右に進むほど圧力が下がることになりますね.
よって,圧力を加えることでルシャトリエの原理から圧力を下げようとする右向きに反応が進むことになるので,ハーバー・ボッシュ法では高圧下で反応を進めるのが良いわけですね.
また,ハーバー・ボッシュ法の反応が発熱反応です:
このことに注目すると,ハーバー・ボッシュ法では反応が右に進むほど熱が発生するということになります.
よって,温度を下げることでルシャトリエの原理から温度を上げようとする右向きに反応が進むことになります.
以上をまとめると,次のようになりますね.
ハーバー・ボッシュ法では低温高圧の状況を作り出すことで反応が進む.
ここでの低温といっても200℃程度(高温は700℃程度)です.工業的製法なので,実験室でチマチマ行う化学反応とは低温の格が違いますね.
補足(実は低温にしすぎては効率が悪い)
少し発展的な内容ですが,実は低温にしすぎると効率が悪いことも補足で説明しておきます.
上で説明したように,低温にするほど平衡に達したときのアンモニア$\mrm{NH_3}$の量は多くなります.しかし,低温にするほど平衡に達するまでに時間がかかるという欠点ががあります.
一方,高温にすると平衡に達したときのアンモニア$\mrm{NH_3}$の量は少ないのですが,短い時間で反応が平衡に達します.
そこで,工業的にはその間の丁度いい温度をとって,収集率は若干劣るが反応がそこそこ速い約400℃で反応を起こし,何度もこの操作を繰り返すことで効率を上げます.
ハーバー・ボッシュ法はいろんな物質を反応させるわけではなく,ルシャトリエの原理をうまく工夫して利用しているだけなので,少々特殊な製法と言えるかもしれませんね.

コメント