高校化学で特に重要な工業的製法は5つあります.
そのうちの1つであるクメン法はフェノール$\mrm{CH_5OH}$の製法で,主な原料はベンゼン$\mrm{C_6H_6}$とプロピレン$\mrm{CH_3-CH=CH_2}$です.
クメン法は
ベンゼンとプロピレン → クメン → クメンヒドロペルオキシド → フェノール
という流れでフェノールをつくります.
ガスバーナー程度しか使わない「実験室的製法」に対して,「工業的製法」はビジネス用の製法で利益の上がるように物質を作るのが目標です.そのため「無駄なく,安くを目指した製法」となっており,ガンガン圧力をかけたり,高温にすることができるのも特徴です.
この記事では
- クメン法で必要な物質と生成物
- クメン法の考え方と流れ
を順に説明します.
「工業的製法」の一連の記事
クメン法で必要な物質と生成物
クメン法と名前が付いていますが,クメン法はベンゼンとプロピレンをもとにした「フェノールの製法」であることに注意してください.
ベンゼン$\mrm{C_6H_6}$
ベンゼンは最も簡単な芳香族炭化水素ですね.構造式は
です.6個の炭素$\mrm{C}$が環状に繋がっていて,各炭素$\mrm{C}$から1個ずつ水素$\mrm{H}$が生えているような形ですね.
プロピレン$\mrm{CH_3-CH=CH_2}$
プロパン$\mrm{CH_3-CH_3-CH_3}$の1つの単結合が2重結合になった物質をプロピレンと呼びます.構造式は
です.
プロピレンは2重結合を1つ含む炭化水素なので「プロペン」と呼んでも間違いではありませんが,普通はプロピレンと呼びます.
フェノール$\mrm{C_6H_5-OH}$
ベンゼンに$\mrm{OH}$が付加した物質をフェノールと呼びます.構造式は
です.このフェノールを作るがクメン法の目的ですね.
クメン法の考え方と流れ
気持ちとしてはベンゼンに酸素$\mrm{O}$を割り込ませて
とフェノールを生成したいのですが,ベンゼン単体ではうまくいきません.
そこで,プロピレンを併せて用意することで,うまくフェノールを作ることができます.
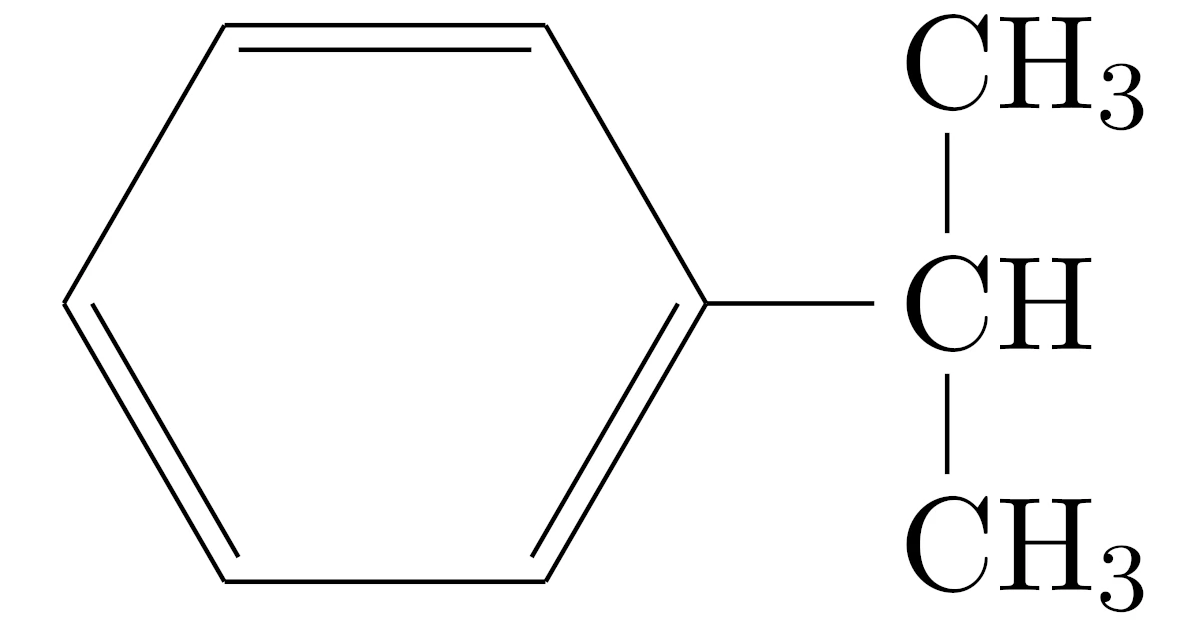
ステップ1(クメンをつくる)
最初にベンゼンにプロピレンを付加させると,次の反応が起こります.
このときにできる物質をクメンといいます.
クメンはプロピレンの2重結合$=$のうちの1本がベンゼンと繋がり,ベンゼンの水素$\mrm{H}$が1個プロピレンの方に移った形になっていますね.
ステップ2(クメンヒドロペルオキシドをつくる)
クメンを空気酸化すると,次の反応が起こります.
このときにできる物質をクメンヒドロペルオキシドといいます.
クメンヒドロペルオキシドはクメンの側鎖の中央の炭素と水素の間に$\mrm{-O-O-}$結合ができた形になっていますね.
$\mrm{-O-O-}$結合をもつ化合物を「ペルオキシド」といい,クメンヒドロペルオキシドは「クメン」と「ヒドロ(水素)」の「ペルオキシド」という意味です.
ステップ3(フェノールをつくる)
クメンヒドロペルオキシドを希硫酸で分解するとフェノールとアセトンができます.
アセトンはケトン基$\mrm{-(C=O)-}$をもつ物質の典型的な例で,有機化学ではよく現れる物質です.
この反応は「クメンヒドロペルオキシドからアセトンがぽろっと離れてそのままフェノールになる」という単純なものではありませんが,少々複雑な反応になり高校範囲を超えるのでここでは触れません.

コメント