高校化学で特に重要な工業的製法は5つあります.
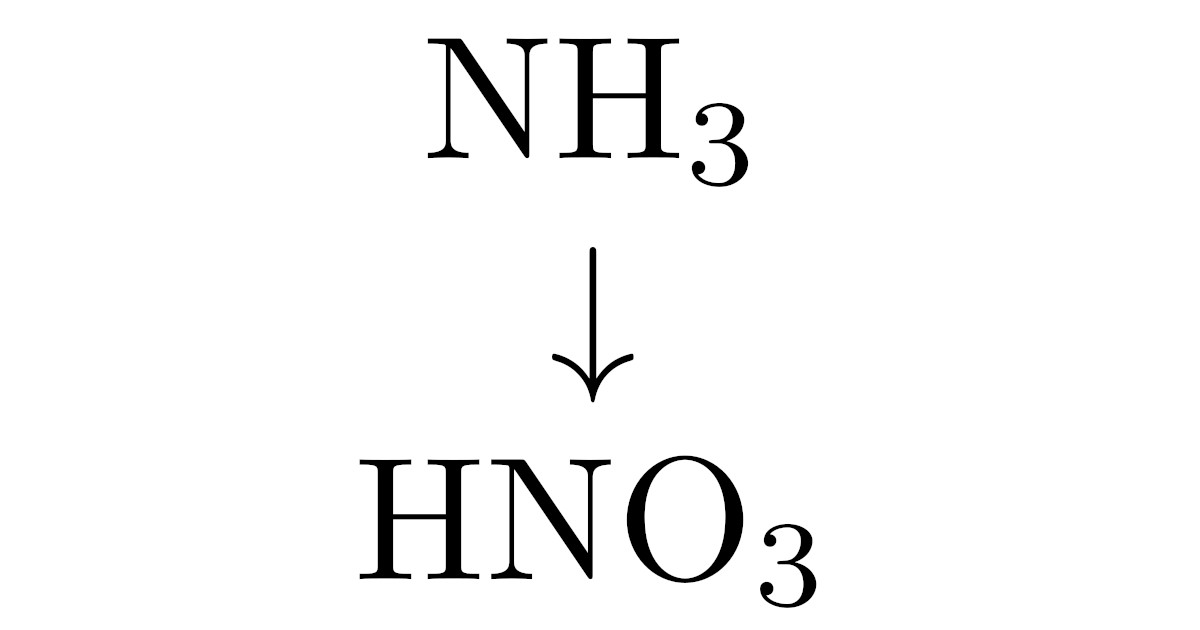
そのうちの1つであるオストワルト法は硝酸$\mrm{HNO_3}$の製法で,主な原料はアンモニア$\mrm{NH_3}$です.オストワルト法は
アンモニア$\mrm{NH_3}$ → 一酸化窒素$\mrm{NO}$ → 酸化窒素$\mrm{NO_2}$ → 硝酸$\mrm{HNO_3}$
という流れで硝酸$\mrm{HNO_3}$をつくります.
オストワルト法でのポイントは
- アンモニア$\mrm{NH_3}$を酸化させる際は高温にする
- 一酸化窒素$\mrm{NO}$の処理
です.
ガスバーナー程度しか使わない「実験室的製法」に対して,「工業的製法」はビジネス用の製法で利益の上がるように物質を作るのが目標です.そのため「無駄なく,安くを目指した製法」となっており,ガンガン圧力をかけたり,高温にすることができるのも特徴です.
「工業的製法」の一連の記事
オストワルト法の流れ
オストワルト法で必要なものは
- アンモニア$\mrm{NH_3}$
- 酸素$\mrm{O_2}$
- 水$\mrm{H_2O}$
- 白金(触媒)
です.流れは
- アンモニア$\mrm{NH_3}$を酸化させて,一酸化窒素$\mrm{NO}$
- 一酸化窒素$\mrm{NO}$を酸化させて,二酸化窒素$\mrm{NO_2}$
- $\mrm{NO_2}$を水に溶かして硝酸$\mrm{HNO_3}$
という3ステップです.
白金は触媒なので反応を促進するためにあるだけで,化学反応の中には登場しません.
ステップ1(一酸化窒素$\mrm{NO}$をつくる)
アンモニア$\mrm{NH_3}$と酸素$\mrm{O_2}$を800度の白金触媒に触れさせることで,次の反応が起こります.
800度と非常に高温にできるあたり,実験室的製法でなく工業的製法であることが分かりますね.
なお,アンモニアも高校数学で重要な工業的製法であるハーバー・ボッシュ法で作られることもおさえておきましょう.
ステップ2(二酸化窒素$\mrm{NO_2}$をつくる)
一酸化窒素$\mrm{NO}$は140度以下で空気中の酸素$\mrm{O_2}$と容易に反応して,次の反応が起こります.
ステップ3(硝酸$\mrm{HNO_3}$をつくる)
二酸化窒素$\mrm{NO_2}$は水によく溶けます.
こうしてできた水溶液の正体が硝酸$\mrm{HNO_3}$で,反応は次のようになっています.
ポイント
冒頭でも触れましたが,オストワルト法でのポイントは次の2つです.
- アンモニア$\mrm{NH_3}$を酸化させる際は高温にする
- 一酸化窒素$\mrm{NO}$の処理
アンモニア$\mrm{NH_3}$を酸化させる際は高温にする
一酸化窒素$\mrm{NO}$を作るとき,「アンモニア$\mrm{NH_3}$と酸素$\mrm{O_2}$を800度の白金触媒に触れさせる」と書きました.
このように温度を高くしなければならないのは一酸化窒素$\mrm{NO}$に関する反応
が吸熱反応であることが理由です.
ここでは,次のルシャトリエの原理が大切です.
[ルシャトリエの原理]可逆反応が平衡状態にあるとき,外部から平衡を支配する条件(温度,圧力,濃度)を変えると,その影響を緩和する方向へ平衡が移動し,新しい平衡状態となる.
つまり,「環境が変化するとその環境を元に戻そうとする向きに化学反応が進む」というのがルシャトリエの原理なわけですね.
さて,もし低温で最初の反応
を起こしてしまうと,上の反応$(*)$が左に進むことでせっかく生成した一酸化窒素$\mrm{NO}$が分解してしまいます.
そこで,高温にして反応を起こすと低温にしようと吸熱反応$(*)$が右に進み,生成した一酸化窒素$\mrm{NO}$の分解を阻止できるわけですね.
なお,ルシャトリエの原理は次の記事で扱う工業的製法であるハーバー・ボッシュ法でも重要な役割を果たします.
一酸化窒素$\mrm{NO}$の再利用
工業的製法は無駄なく安くが基本なのでした.そう考えると,最後の反応
で出てきた一酸化窒素$\mrm{NO}$をこのまま棄てると無駄が出てしまうことになり良くありません.
そこで,最後に出てきた一酸化窒素$\mrm{NO}$を,最初に作った一酸化窒素$\mrm{NO}$に混ぜて再利用します.
オストワルト法に限らず工業的製法では再利用がよく行われます.工業的製法を考えるときには,どのような「営業努力」が行われているのかを考えると少し面白いかもしれません.

コメント