高校化学で特に重要な工業的製法は5つあります.
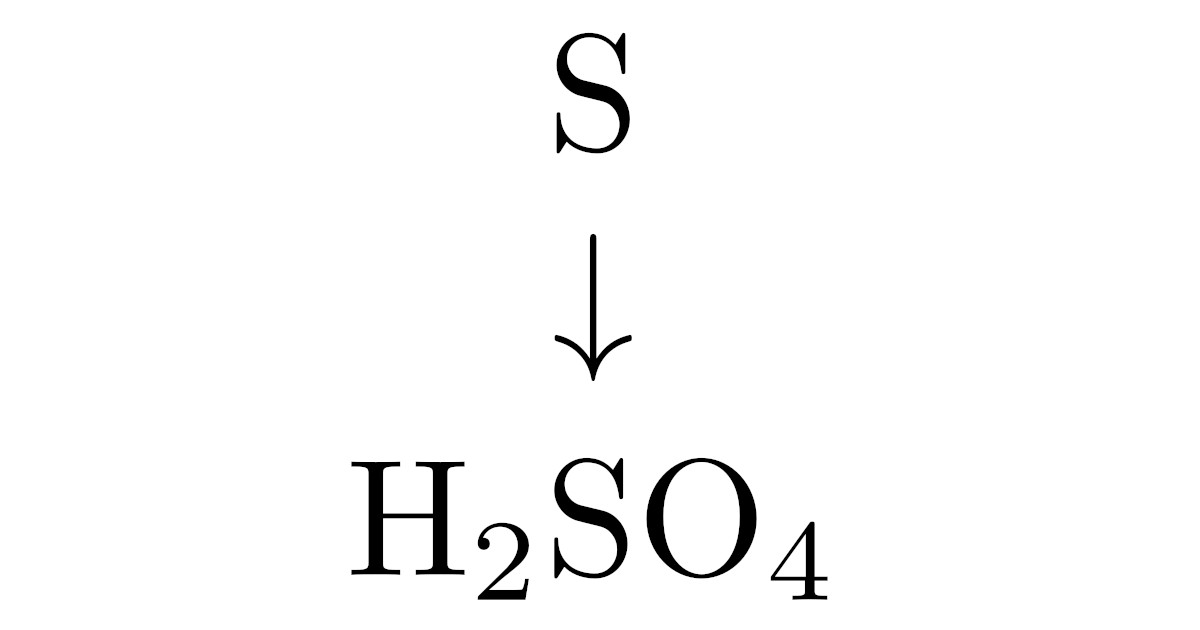
そのうちの1つである接触法は濃硫酸$\mrm{H_2SO_4}$の製法で,主な原料は硫黄$\mrm{S}$です.接触法は
硫黄$\mrm{S}$ → 二酸化硫黄$\mrm{SO_2}$ → 三酸化硫黄$\mrm{SO_3}$ → 濃硫酸$\mrm{H_2SO_4}$
という流れで濃硫酸をつくります.
流れはアンモニア$\mrm{NH_3}$をどんどん酸化させて硝酸$\mrm{HNO_3}$の製法であるオストワルト法に似ていますね.
濃硫酸は化学のいたるところで用いられる極めて重要な物質なので,その作り方である接触法も理解しておきましょう.
ガスバーナー程度しか使わない「実験室的製法」に対して,「工業的製法」はビジネス用の製法で利益の上がるように物質を作るのが目標です.そのため「無駄なく,安くを目指した製法」となっており,ガンガン圧力をかけたり,高温にすることができるのも特徴です.
「工業的製法」の一連の記事
接触法の流れ
接触法で必要なものは
です.なお,酸化バナジウム(V)$\mrm{V_2O_5}$は触媒ですね.流れは
- 硫黄$\mrm{S}$を酸化させて,二酸化硫黄$\mrm{SO_2}$をつくる.
- 二酸化硫黄$\mrm{SO_2}$を酸化させて,三酸化硫黄$\mrm{SO_3}$をつくる.
- 三酸化硫黄$\mrm{SO_3}$を濃硫酸に吸収させ,希硫酸で薄めて濃硫酸$\mrm{H_2SO_4}$をつくる.
という3ステップです.
また,硫酸は化学のいたるところで用いられる物質なので,性質はしっかり把握しておいてください.
硫黄$\mrm{S}$を燃焼させる
二酸化硫黄$\mrm{SO_2}$は硫黄$\mrm{S}$を燃焼させると発生します.
\begin{align*}\mrm{S + O_2 \to SO_2}\end{align*}
一酸化硫黄$\mrm{SO}$は非常に不安定な物質であり,硫黄を燃焼させると二酸化硫黄$\mrm{SO_2}$になります.
二酸化硫黄$\mrm{SO_2}$を三酸化硫黄$\mrm{SO_3}$にする
酸化バナジウム(V)$\mrm{V_2O_5}$に二酸化硫黄$\mrm{SO_2}$を触れさせ,酸素$\mrm{O_2}$を吹き付けると,二酸化硫黄$\mrm{SO_2}$が酸化されて三酸化硫黄$\mrm{SO_3}$になります.
\begin{align*}\mrm{2SO_2 + O_2 \to 2SO_3}\end{align*}
ここで,酸化バナジウム(V)$\mrm{V_2O_5}$は触媒としてはたらいています.
「接触法」という名前は,酸化バナジウム(V)$\mrm{V_2O_5}$に二酸化硫黄$\mrm{SO_2}$を接触させることに由来しています.
三酸化硫黄$\mrm{SO_3}$を濃硫酸に吸収させる
三酸化硫黄$\mrm{SO_3}$を濃硫酸$\mrm{H_2SO_4}aq$に溶かします.
\begin{align*}\mrm{SO_3 + H_2SO_4 \to H_2S_2O_7}\end{align*}
三酸化硫黄を溶かした濃硫酸$\mrm{H_2S_2O_7}$を「発煙硫酸」と言いますが,これは覚えていなくても構いません.
正確には,「発煙硫酸」は$\mrm{H_2SO_4}$を含んだ平衡状態の溶液のことを言いますが,これについてはこの記事の最後に補足します.
発煙硫酸を希硫酸で希釈する
発煙硫酸$\mrm{H_2S_2O_7}$に希硫酸を加えると,希硫酸中の水$\mrm{H_2O}$が発煙硫酸$\mrm{H_2S_2O_7}$に溶けた三酸化硫黄$\mrm{SO_3}$と反応して濃硫酸となります.
\begin{align*}\mrm{SO_3 + H_2O \to H_2SO_4}\end{align*}
発煙硫酸はあくまで平衡溶液の名前であって,発煙硫酸という物質ではないことです.したがって,「発煙硫酸と反応する」という言い方は変であることに注意してください.
なんにせよ,結局は「発煙硫酸」に溶けている三酸化硫黄$\mrm{SO_3}$と希硫酸中の水$\mrm{H_2O}$が反応し,濃硫酸ができあがります.
まとめ
以上をまとめると,接触法の流れは
\begin{align*}\mrm{S \xrightarrow[]{+ O} SO_2 \xrightarrow[]{+ O + V_2O_5} SO_3 ( \xrightarrow[]{+ H_2SO_4} H_2S_2O_7 ) \xrightarrow[]{+ H_2O} H_2SO_4}\end{align*}
となります.それぞれの反応は
\begin{align*}\begin{matrix}
\mrm{S + O_2}&\to&\mrm{SO_2}\\
\mrm{2SO_2 + O_2}&\to&\mrm{2SO_3}\\
\big(\mrm{SO_3 + H_2SO_4}&\to&\mrm{H_2S_2O_7}\big)\\
\mrm{SO_3 + H_2O}&\to&\mrm{H_2SO_4}
\end{matrix}\end{align*}
ですね.
補足
上の説明では,三酸化硫黄$\mrm{SO_3}$は
- 濃硫酸に溶かし(て発煙硫酸にしてから)
- 希硫酸と反応させる
と2つのステップを踏みました.
しかし,高校化学ではこのあたりの細かい話を抜きにして,「三酸化硫黄$\mrm{SO_3}$を硫酸中の水と反応させて濃硫酸$\mrm{H_2SO_4}$とする」としてしまうこともよくあります.
このため,3つ目の
\begin{align*}\mrm{SO_3 + H_2SO_4 \to H_2S_2O_7}\end{align*}
は高校化学では扱わないのが普通です.しかし,それだと三酸化硫黄$\mrm{SO_3}$を一旦濃硫酸に吸収させる理由が曖昧になるので,この記事では敢えて扱いました.

コメント