「酸化還元反応の半反応式はややこしくて覚えられない!」という声を聞くことがありますが,半反応式で覚えるべき部分は一部だけで残りは機械的に導けるようになっています.
さらに,半反応式が書ければ,その先の酸化還元反応の化学式もやはり機械的に導くことができます.
つまり,酸化還元反応を導くには
- 半反応式で必要な箇所を覚える
- 半反応式を導く
- 酸化還元反応式を導く
の3ステップでよく,覚える必要のある部分は最初のステップだけです(3つ目のステップについては,のちの記事で説明します).
この記事では
- 半反応式の一覧
- 半反応式で覚えるべき箇所と導くべき箇所
- 半反応式の導き方の具体例
を順に説明します.
「酸化還元反応」の一連の記事
酸化剤と還元剤
酸化還元反応を考えるときどの物質が酸化されるのか,還元されるのかを把握することは大切です.
酸化剤
物質の酸化と還元は電子$\mrm{e^-}$を放出するか受け取るかの違いで,
- 電子$\mrm{e^-}$を放出するとき,その物質は酸化される
- 電子$\mrm{e^-}$を受け取るとき,その物質は還元される
ということを思い出しておきましょう.
ある物質$\mrm{A}$が電子$\mrm{e^-}$を放出する(酸化される)とき,「その電子$\mrm{e^-}$を受け取ったヤツ」がいることになります.言い換えれば,物質$\mrm{A}$の「酸化を引き起こすヤツ」がいるはずです.
この「酸化を引き起こすヤツ」を次のようにいいます.
相手を酸化させる物質のことを酸化剤という.
ここで注意したいところは,酸化剤自体は(電子$\mrm{e^-}$を受け取るので)自分は還元されるという点です.
消臭剤は周囲を消臭するのであって,自分が消臭されるわけではありませんね.
還元剤
同様に,ある物質が電子$\mrm{e^-}$を受け取る(還元される)とき,「その電子$\mrm{e^-}$を失ったヤツ」=「還元を引き起こすヤツ」がいることになります.
この「還元を引き起こすヤツ」を次のようにいいます.
相手を還元させる物質のことを還元剤という.
酸化剤とは逆に還元剤自体は(電子$\mrm{e^-}$を放出するので)は酸化されるという点に注意してください.
半反応式の一覧
酸化還元反応の反応式は半反応式がベースにあるため,酸化還元反応の反応式がどうなるかを知るためには半反応式が書ける必要があります.
そこで,よく扱われる典型的な半反応式はきちんとフォローしておくことが大切で,以下のように一覧になっています.
しかし,冒頭でも説明したように,半反応式は部分的に覚えるだけで半反応式の残りの部分は導くことができます.この
- 半反応式で覚えるべき箇所
- 半反応式で導くべき箇所
については,半反応式の一覧の下で説明します.
酸化剤の半反応式
酸化剤の半反応式です.酸化剤は電子$\mrm{e^-}$を受け取るので,左辺に電子$\mrm{e^-}$がありますね.
| 物質/化学式 | 半反応式 |
|---|---|
| オゾン $\mrm{O_3}$ (酸性) |
$\mrm{O_3 + 2H^+ + 2e^- \to O_2 + H_2O}$ |
| 過酸化水素 $\mrm{H_2O_2}$ (酸性) |
$\mrm{H_2O_2 + 2H^+ + 2e^- \to 2H_2O}$ |
| 過酸化水素 $\mrm{H_2O_2}$ (中性・塩基性) |
$\mrm{H_2O_2 + 2e^- \to 2OH^+}$ |
| 過マンガン酸カリウム $\mrm{KMnO_4}$ (酸性) |
$\mrm{MnO_4^- + 8H^+ + 5e^- \to Mn^{2+} + 4H_2O}$ |
| 過マンガン酸カリウム $\mrm{KMnO_4}$ (中性・塩基性) |
$\mrm{MnO_4^- + 2H_2O + 3e^- \to MnO_2 + 4OH^+}$ |
| 濃硝酸 $\mrm{HNO_3}$ | $\mrm{HNO_3 + H^+ + e^- \to NO_2 + H_2O}$ |
| 希硝酸 $\mrm{HNO_3}$ | $\mrm{HNO_3 + 3H^+ + 3e^- \to NO + 2H_2O}$ |
| 熱濃硫酸 $\mrm{H_2SO_4}$ | $\mrm{H_2SO_4 + 2H^+ + 2e^- \to SO_2 + 2H_2O}$ |
| 二クロム酸カリウム $\mrm{K_2Cr_2O_7}$ (酸性) |
$\mrm{Cr_2O_7^{2-} + 14H^+ + 6e^- \to 2Cr^{3+} + 7H_2O}$ |
| ハロゲン $\mrm{X_2}$ | $\mrm{X_2 + 2e^- \to 2X^-}$ |
| 二酸化硫黄 $\mrm{SO_2}$ | $\mrm{SO_2 + 4H^+ + 4e^- \to S + 2H_2O}$ |
| 酸素 $\mrm{O_2}$ | $\mrm{O_2 + 4e^- \to 2O^{2-}}$ |
ただし,ハロゲンの$\mrm{X}$は具体的にフッ素$\mrm{F}$,塩素$\mrm{Cl}$,臭素$\mrm{Br}$などに読み換えてください.つまり,それぞれ
\begin{align*}&\mrm{F_2 + 2e^- \to 2F^-},
\\&\mrm{Cl_2 + 2e^- \to 2Cl^-},
\\&\mrm{Br_2 + 2e^- \to 2Br^-}\end{align*}
となります.
過酸化水素$\mrm{H_2O_2}$と過マンガン酸カリウム$\mrm{KMnO_4}$での酸性条件と中性・塩基性条件については次の記事で説明します.
還元剤の半反応式
還元剤の半反応式です.還元剤は電子$\mrm{e^-}$を放出するので,右辺に電子$\mrm{e^-}$がありますね.
| 物質/化学式(条件) | 半反応式 |
|---|---|
| 塩化スズ(II) $\mrm{SnCl_2}$ | $\mrm{Sn^{2+} \to Sn^{4+} + 2e^-}$ |
| 硫酸鉄(II) $\mrm{FeSO_4}$ | $\mrm{Fe^{2+} \to Fe^{3+} + e^-}$ |
| 硫化水素 $\mrm{H_2S}$ | $\mrm{H_2S \to S + 2H^+ + 2e^-}$ |
| 過酸化水素 $\mrm{H_2O_2}$ | $\mrm{H_2O_2 \to O_2 + 2H^+ + 2e^-}$ |
| 二酸化硫黄 $\mrm{SO_2}$ | $\mrm{SO_2 + 2H_2O \to SO_4^{2-} + 4H^+ + 2e^-}$ |
| アルカリ金属 $\mrm{X}$ | $\mrm{X \to X^{+} + e^-}$ |
| アルカリ土類金属 $\mrm{X}$ | $\mrm{X \to X^{2+} + 2e^-}$ |
| シュウ酸 $\mrm{(COOH)_2}$ | $\mrm{(COOH)_2 \to 2CO_2 + 2H^+ + 2e^-}$ |
| ヨウ化カリウム $\mrm{KI}$ | $\mrm{2I^- \to I_2 + 2e^-}$ |
| 水素 $\mrm{H_2}$ | $\mrm{H_2 \to 2H^+ + 2e^-}$ |
| チオ硫酸ナトリウム $\mrm{Na_2S_2O_3}$ | $\mrm{2S_2O_3^{2-} \to S_4O_6^{2-} + 2e^-}$ |
アルカリ金属・アルカリ土類金属以外の金属についても,
\begin{align*}\mrm{X \to X^{2+} + 2e^-}\end{align*}
型の半反応式となりますが,物質によって$n$が変わります.たとえば,
\begin{align*}&\mrm{Li \to Li^+ + e^-},
\\&\mrm{Mg \to Mg^{2+} + 2e^-},
\\&\mrm{Ag \to Ag^+ + e^-},
\\&\mrm{Cu \to Cu^{2+} + 2e^-}\end{align*}
などとなります.
半反応式の覚えるべき部分と導き方
半反応式を導く手順は次の通りです.
- 酸化剤/還元剤の「変化後の物質(イオン)」を覚える
- $\mrm{O}$が足りない方に$\mrm{H_2O}$を足して$\mrm{O}$の個数を合わせる
- $\mrm{H}$が足りない方に$\mrm{H^+}$を足して$\mrm{H}$の個数を合わせる
- 両辺の電荷が等しくなるように,電子$\mrm{e^-}$を足して電荷を合わせる
つまり,覚えるものは変化後の物質(イオン)だけで十分です.
具体的にいくつか半反応式を導きましょう.
具体例1(濃硝酸$\mrm{HNO_3}$)
濃硝酸$\mrm{HNO_3}$の半反応式を導け.
ステップ1
濃硝酸$\mrm{HNO_3}$の変化後の物質は二酸化窒素$\mrm{NO_2}$です.
\begin{align*}\mrm{HNO_3 \to NO_2}\quad\dots(1)\end{align*}
これは覚えておきます.
ステップ2
(1)では左辺に$\mrm{O}$が3個,右辺に$\mrm{O}$が2個あります.
つまり,右辺に$\mrm{O}$が1個不足しているので,右辺に$\mrm{H_2O}$を1個足します.
\begin{align*}\mrm{HNO_3 \to NO_2 + H_2O}\quad\dots(2)\end{align*}
ステップ3
(2)では左辺に$\mrm{H}$が1個,右辺に$\mrm{H}$が2個あります.
つまり,左辺に$\mrm{H}$が1個不足しているので,左辺に$\mrm{H^+}$を1個足します.
\begin{align*}\mrm{HNO_3 + H^+ \to NO_2 + H_2O}\quad\dots(3)\end{align*}
ステップ4
(3)では左辺に$\mrm{H^+}$の1個あるので左辺の電荷は$+1$,右辺は電荷が$0$です.
つまり,左辺の電荷が$1$多いので,左辺に$\mrm{e^-}$を1個足します.
\begin{align*}\mrm{HNO_3 + H^+ + e^- \to NO_2 + H_2O}\end{align*}
これで半反応式の完成です.
完成した半反応式の左辺に電子$\mrm{e^-}$がありますから,濃硝酸$\mrm{HNO_3}$が電子$\mrm{e^-}$を受け取っているので酸化剤であることも分かりますね.
具体例2(酸性条件下での過マンガン酸カリウム)
酸性条件下での過マンガン酸カリウム$\mrm{KMnO_4}$の半反応式を導け.
ステップ1
酸性条件下での過マンガン酸カリウム$\mrm{KMnO_4}$の変化後のイオンはマンガン(II)イオン$\mrm{Mn^{2+}}$です.
\begin{align*}\mrm{MnO_4^- \to Mn^{2+}}\quad\dots(1)\end{align*}
これは覚えておきます.
ステップ2
(1)では左辺に$\mrm{O}$が4個,右辺に$\mrm{O}$がありません.
つまり,右辺に$\mrm{O}$が4個不足しているので,右辺に$\mrm{H_2O}$を4個足します.
\begin{align*}\mrm{MnO_4^- \to Mn^{2+} + 4H_2O}\quad\dots(2)\end{align*}
ステップ3
(2)では左辺に$\mrm{H}$がなく,右辺に$\mrm{H}$が8個あります.
つまり,左辺に$\mrm{H}$が8個不足しているので,左辺に$\mrm{H^+}$を8個足します.
\begin{align*}\mrm{MnO_4^- + 8H^+ \to Mn^{2+} + 4H_2O}\quad\dots(3)\end{align*}
ステップ4
(3)では左辺に$\mrm{MnO_4^-}$が1個,$\mrm{H^+}$が8個あるので左辺の電荷は$+7$,右辺は$\mrm{Mn^{2+}}$が1個あるので電荷が$+2$です.
つまり,左辺の電荷が$5$多いので,左辺に$\mrm{e^-}$を5個足します.
\begin{align*}\mrm{MnO_4^- + 8H^+ + 5e^- \to Mn^{2+} + 4H_2O}\end{align*}
これで半反応式の完成です.
完成した半反応式の左辺に電子$\mrm{e^-}$がありますから,酸性条件下での過マンガン酸カリウム$\mrm{KMnO_4}$が電子$\mrm{e^-}$を受け取っているので酸化剤であることも分かりますね.
具体例3(チオ硫酸ナトリウム)
チオ硫酸ナトリウム$\mrm{Na_2S_2O_3}$の半反応式を導け.
ステップ1
チオ硫酸ナトリウム$\mrm{Na_2S_2O_3}$の変化後のイオンは四チオン酸イオン$\mrm{S_4O_6^{2-}}$です.
\begin{align*}\mrm{2S_2O_3^{2-} \to S_4O_6^{2-}}\quad\dots(1)\end{align*}
これは覚えておきます.
ステップ2
(1)では左辺に$\mrm{O}$が4個,右辺にも$\mrm{O}$が4個あります.
つまり,既に両辺の$\mrm{O}$の個数が一致しているので,$\mrm{H_2O}$は足さずに(1)のままにしておきます.
\begin{align*}\mrm{2S_2O_3^{2-} \to S_4O_6^{2-}}\quad\dots(1)\end{align*}
ステップ3
(1)では左辺に$\mrm{H}$がなく,右辺にも$\mrm{H}$がありません.
つまり,既に両辺の$\mrm{H}$の個数が一致しているので,$\mrm{H^+}$は足さずに(1)のままにしておきます.
\begin{align*}\mrm{2S_2O_3^{2-} \to S_4O_6^{2-}}\quad\dots(1)\end{align*}
ステップ4
(1)では左辺に$2\mrm{S_2O_3^{2-}}$が2個あるので左辺の電荷は$-4$,右辺は$\mrm{S_4O_6^{2-}}$が1個あるので電荷は$-2$です.
つまり,右辺の電荷が$2$多いので,左辺に$\mrm{e^-}$を2個足します.
\begin{align*}\mrm{2S_2O_3^{2-} \to S_4O_6^{2-} + 2e^-}\end{align*}
これで半反応式の完成です.
完成した半反応式の右辺に電子$\mrm{e^-}$がありますから,チオ硫酸ナトリウム$\mrm{Na_2S_2O_3}$が電子$\mrm{e^-}$を放出しているので還元剤剤であることも分かりますね.
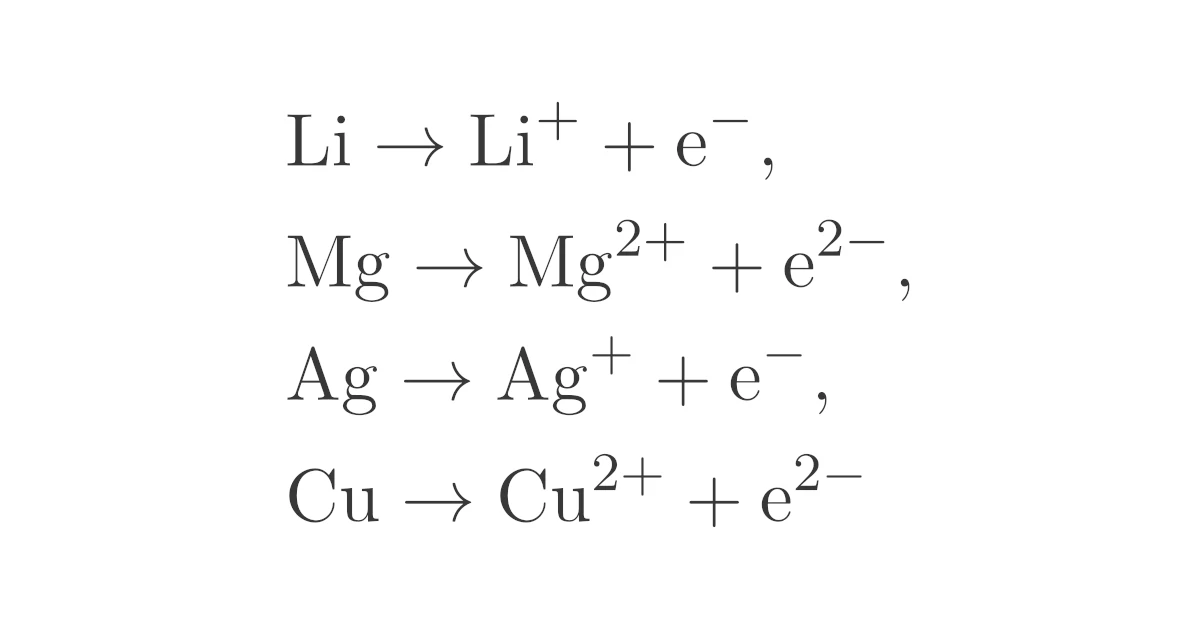

コメント
酸化剤が還元剤になっています
ご指摘ありがとうございます!表の最初の部分ですね.修正しました.
水素の半反応式のH+がH-になってます
ご指摘ありがとうございます!修正しました!