 酸化還元反応
酸化還元反応 酸化還元反応の酸性条件と中性・塩基性条件で何が変わる?
過酸化水素H₂O₂や過マンガン酸カリウムKMnO₄の半反応式は,溶液が酸性の場合と中性・塩基性の場合で異なります.この記事では溶液が酸性なのか中性・塩基性なのかで半反応式が変わる理由と,どのように覚え分けるかを説明します.
 酸化還元反応
酸化還元反応 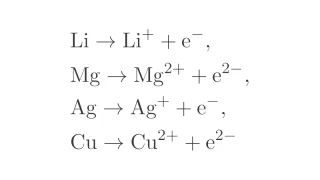 酸化還元反応
酸化還元反応 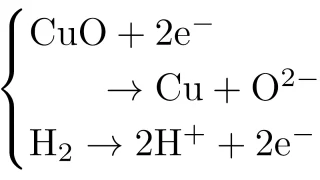 酸化還元反応
酸化還元反応 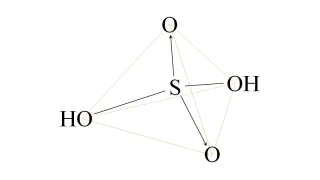 物質の性質
物質の性質 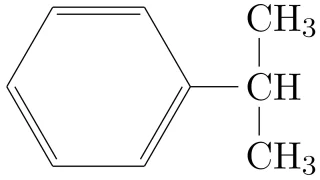 工業的製法
工業的製法 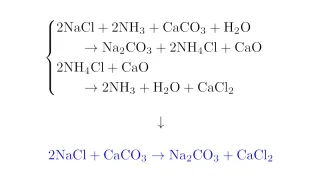 工業的製法
工業的製法  工業的製法
工業的製法 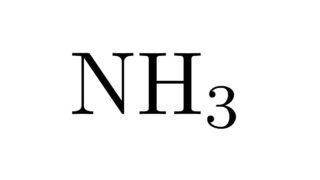 工業的製法
工業的製法 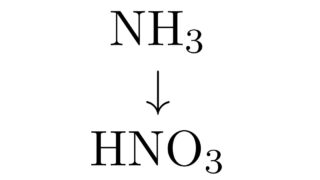 工業的製法
工業的製法 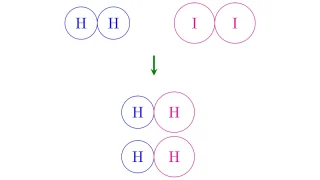 化学
化学