電池は現代の生活になくてはならないものとなっていますが,電池はどのようにして電流を生み出しているのでしょうか?
実はそもそも電流とは「電子$\mrm{e^-}$の流れ」のことで,したがって電池は「電子$\mrm{e^-}$の流れ発生させる装置」ということができます.
この電子$\mrm{e^-}$の流れを発生させるために鍵となるのが酸化還元反応です.
そもそも電子$\mrm{e^-}$のやりとりのある化学反応のことを酸化還元反応というのでしたから,酸化還元反応で起こる電子$\mrm{e^-}$のやりとりを導線などを介して引き起こすことができれば,導線の中の電子$\mrm{e^-}$の移動(すなわち,電流)を生み出すことができそうです.
これが電池の仕組みです.
この記事では
- 化学電池とは何か?
- 電子$\mrm{e^-}$の流れと電流の向き
を順に説明します.
「電池と電気分解」の一連の記事
化学電池とは何か?
電池とは「電流を生み出す装置」のことをいい,大まかには
- 物理電池
- 化学電池
の2種類に分けられます.
たとえば,手回し式のライトなどは内部の磁石が回転して誘導電流が発生するタイプの電池で,これは物理的に電気を得るので物理電池です.
化学電池とは何か?
高校化学で学ぶ電池は一方の化学電池です.
身近にある化学電池は乾電池です.乾電池の内部では化学反応が起こっており,これにより電流を作り出しています.
化学反応に伴って放出されるエネルギーを,(直流の)電気エネルギーに変える装置を化学電池という.
たとえば,中和反応が起こると中和熱が生じますが,この中和熱は化学反応に伴って放出される熱エネルギーです.
同様に化学反応に伴って電気エネルギーが放出されることがあり,この「電気エネルギーを取り出す装置」を電池というわけですね.
簡単な化学電池(ボルタ電池)
のちの記事で詳しく説明しますが,基本的な電池で有名なものといえばボルタ電池です.
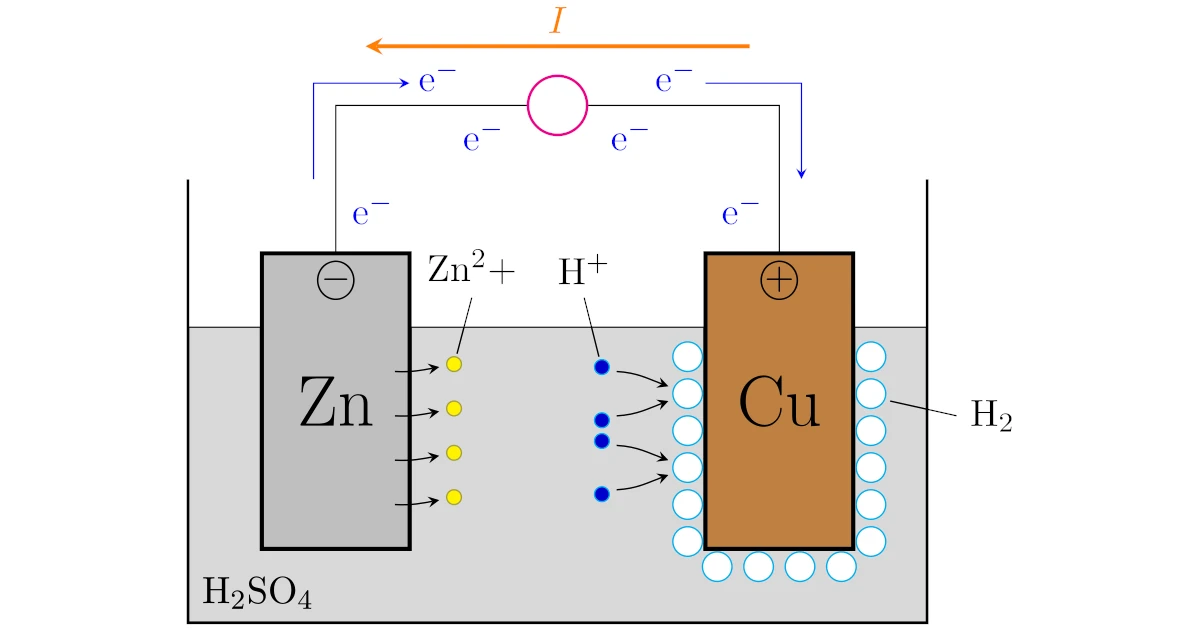
ボルタ電池は亜鉛$\mrm{Zn}$と銅$\mrm{Cu}$をボチャッと希硫酸$\mrm{H_2SO_4}$に浸けて,導線で亜鉛$\mrm{Zn}$と銅$\mrm{Cu}$を結べば完成します.
このボルタ電池では,亜鉛$\mrm{Zn}$側で
銅$\mrm{Cu}$側で
という反応が起こります.
図の導線の途中にある〇は抵抗で,たとえば豆電球だと思えばイメージとしては十分です.
酸化還元反応の言葉を使えば,亜鉛$\mrm{Zn}$は酸化され,水素イオン$\mrm{H^+}$は還元されているわけですね.
このように,酸化還元反応で起こる電子$\mrm{e^-}$のやりとりを導線を介して引き起こすことで,電子$\mrm{e^-}$が利用できるようになるわけですね.
電子$\mrm{e^-}$の流れと電流の向き
いまの説明が分かれば,我々が普段から電流と言っているものは,実は電子$\mrm{e^-}$の移動のことを指していることが分かりますね.
電子$\mrm{e^-}$と電流
電子$\mrm{e^-}$の移動を電流というわけですから,電流にも向きを考えることができます.
「電子$\mrm{e^-}$の移動方向」と逆向きを「電流の向き」と定める.
よって,先ほど説明したボルタ電池では$\mrm{Cu}$電極から$\mrm{Zn}$電極へ流れる向きに電流$I$が流れている,ということになりますね.
一般に電流(の大きさ)は$I$で表すことが多いです.
電流の向き
では,なぜ電流の向きを電子$\mrm{e^-}$の逆向きと定めるなのでしょうか?これに答えるには電子$\mrm{e^-}$の発見より以前の話をしなければなりません.
電気の存在が知られ始めた頃は「何か分からんけど,ビリビリするものが流れている」という程度の認識で,電子$\mrm{e^-}$の存在は知られていませんでした.
そこで,研究者たちはこのビリビリを「正の電荷が流れている」として電池を研究し始めることにしました.しかし,研究が進むにつれ
- どうやら電子$\mrm{e^-}$というものがあるらしい
- どうやら電子$\mrm{e^-}$の移動を我々は電流と言っているらしい!
- どうやら電子$\mrm{e^-}$は負の電荷をもつらしい!!
ということが分かっていきます.
つまり,正の電荷が流れていると思っていたものが,実は負の電荷をもつ電子$\mrm{e^-}$が逆向きに流れていたことがのちに明らかになったわけですね.
しかし,既に定着した$I$の向きを科学界で一斉に変えることは困難だったため,「実際には違うけど『正の電荷が移動している』と仮定した向き」として,電流の向きが電子$\mrm{e^-}$の流れと逆になっているわけですね.

コメント