ボルタ電池はイタリアの物理学者のVolta氏が発明した世界初の化学電池とされています.
なお,Volta氏の名前は電圧の単位であるボルト$[\mrm{V}]$の由来にもなっています.
さて,ボルタ電池は亜鉛$\mrm{Zn}$と銅$\mrm{Cu}$を導線で繋ぎ,希硫酸$\mrm{H_2SO_4}$に浸けるだけのシンプルな構造で簡単に作ることができます.
しかし,ボルタ電池はその単純さの代わりに分極が起こるという欠点を持ち合わせています.
そこで,イギリスの化学者・物理学者であるDaniell氏は分極が起こらないように改良したダニエル電池を発明しました.
この記事では
- 電池の正極と負極
- ボルタ電池の仕組み
- ダニエル電池の仕組み
を順に説明します.
「電池と電気分解」の一連の記事
化学電池の基本構造
化学電池とは「酸化還元反応を利用して電子を取り出す装置」のことをいうのでした.
正極と負極
化学電池の基本構造は次のようになっています.
- 異なる金属$\mrm{A}$, $\mrm{B}$を導線で繋ぐ
- 金属$\mrm{A}$, $\mrm{B}$を溶液$\mrm{X}$にボチャンと浸ける
- (酸化還元反応により自動的に)電子$\mrm{e^-}$が導線の中を移動する
- この移動している電子$\mrm{e^-}$を使う
という手順で電子を取り出す装置が電池なのでした.
図の導線の途中にある〇は抵抗で,たとえば豆電球だと思っていればイメージとしては十分です.
このとき,この電子$\mrm{e^-}$の流れの向きで金属$\mrm{A}$, $\mrm{B}$の正負を以下のように定めます.
金属$\mrm{A}$と金属$\mrm{B}$を繋いで電池を作る.電子$\mrm{e^-}$が電極$\mrm{A}$から電極$\mrm{B}$へ移動するとき,金属$\mrm{B}$を正極,金属$\mrm{A}$を負極という.また,正極と負極をあわせて電極という.
言い換えれば,電子$\mrm{e^-}$が出てくる方の金属を負極,電子$\mrm{e^-}$が入っていく方の金属を正極ということになります.
電子$\mrm{e^-}$がもっている電荷はマイナスなので,「電子$\mrm{e^-}$が出てくる方をマイナス」と考えるのは自然なことですね.
一方,電流の向きは「$+$の電荷が流れていると想定した向き」でしたから,電子$\mrm{e^-}$の流れとは逆向きとなることに注意してください.
電池式
このため
- 電子$\mrm{e^-}$が電極$\mrm{A}$から電極$\mrm{B}$へ流れる
- 電流が金属$\mrm{B}$から金属$\mrm{A}$へ流れる
は同じことを言っていますね.
また,電池の構造を表すために,電池式というものがあります.
溶液$\mrm{X}$に金属$\mrm{A}$,金属$\mrm{B}$を浸けてできた電池は次のような図式で表され,これを電池式という.
電池式を見れば電池の構造がぱっと分かるので,使えるようになっているととても便利です.
ボルタ電池
冒頭で触れたボルタ電池について詳しく説明します.
ボルタ電池の仕組み
ボルタ電池は亜鉛$\mrm{Zn}$と銅$\mrm{Cu}$をボチャッと希硫酸$\mrm{H_2SO_4}aq$に浸けて,導線で亜鉛$\mrm{Zn}$と銅$\mrm{Cu}$を結べば完成です.
$aq$は水溶液の意味でしたね.
銅$\mrm{Cu}$と亜鉛$\mrm{Zn}$をイオン化列での順を見てみると$\mrm{Zn}>\mrm{Cu}$です.
つまり,亜鉛$\mrm{Zn}$の方が陽イオンになりやすいので,ボルタ電池では亜鉛$\mrm{Zn}$が陽イオンとなって溶液中へ溶け出します.
そのため,亜鉛$\mrm{Zn}$から電子$\mrm{e^-}$が出てくるので,亜鉛$\mrm{Zn}$が負極,銅$\mrm{Cu}$が正極となります.
つまり,ボルタ電池の電池式は
となりますね.
電極での反応
上で説明したように,負極の亜鉛$\mrm{Zn}$電極は陽イオンとなって溶け出すので,亜鉛$\mrm{Zn}$電極側での反応は
となっています.
ここで出てきた電子$\mrm{e^-}$が導線通って銅$\mrm{Cu}$側へやって行き,銅$\mrm{Cu}$の表面で水素イオン$\mrm{H^+}$と反応して水素$\mrm{H_2}$が発生します.
すなわち,正極の銅$\mrm{Cu}$側での反応は
となっています.
ボルタ電池の問題点「分極」
どんな化学電池でも使えば使うほどエネルギーが消費され,電池としての電圧は弱くなっていきます.
しかし,ボルタ電池は単純なエネルギーの消費で考えられる以上のスピードで弱くなっていくことが知られています.
このボルタ電池の電圧が急激に小さくなる現象を電池の分極といい,この原因としては次の3つが考えられます.
- 銅$\mrm{Cu}$の表面に発生した水素$\mrm{H_2}$が電子$\mrm{e^-}$と水素イオン$\mrm{H^+}$の反応を阻害する
- 水素$\mrm{H_2}$が発生しすぎて逆反応$\mrm{H_2 \to 2H^+ + 2e^-}$が起こってしまい,電子$\mrm{e^-}$が逆流する
- 亜鉛$\mrm{Zn}$付近に発生した亜鉛イオン$\mrm{Zn^{2+}}$が濃くなりすぎて,亜鉛$\mrm{Zn}$のイオン化が阻害される
そこでなんとかしてボルタ電池の分極を防ぐ方法を考えて考案されたのが,次に説明するダニエル電池です.
実は適当な酸化剤を混ぜることである程度防ぐことはできます.
また,「電池の分極」は物理の電磁気学の「分極」とはまったく別のものです.
ダニエル電池
ダニエル電池はボルタ電池よりも少し構造が複雑になりますが,そのぶん分極が起こらないなどの良さがあります.
ダニエル電池の仕組み
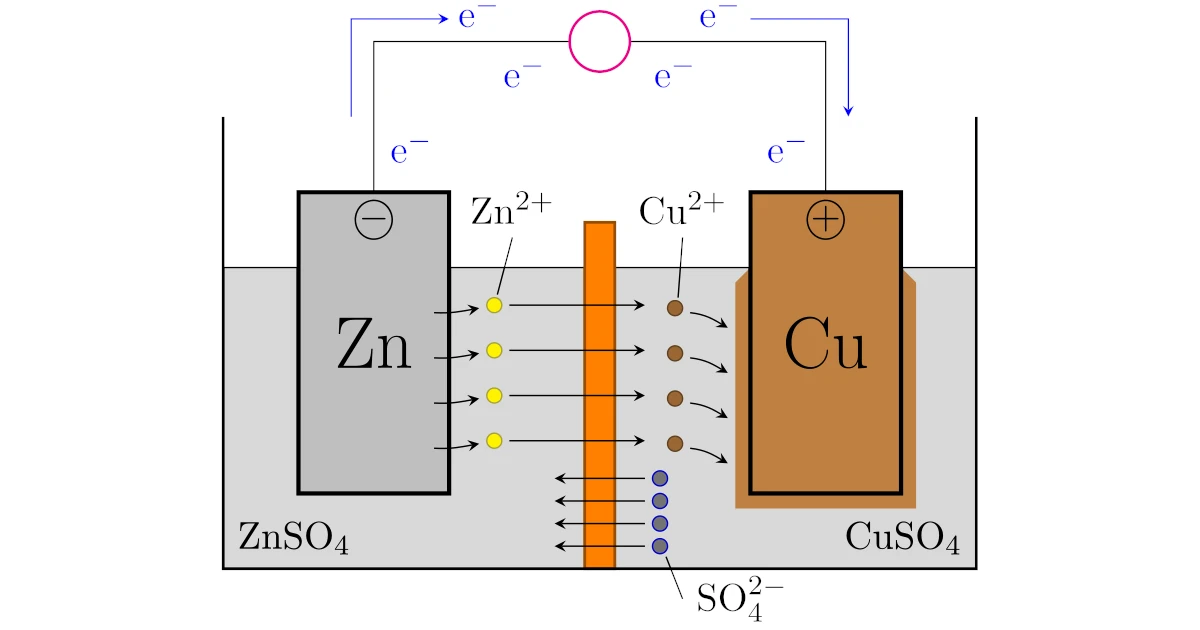
ダニエル電池は素焼き板などの一部のイオンを透過させる板を中央に設置した容器を用意します.
この容器で
- 一方に硫酸亜鉛水溶液$\mrm{ZnSO_4}aq$を入れ,亜鉛$\mrm{Zn}$を浸ける
- 他方に硫酸銅水溶液$\mrm{CuSO_4}aq$を入れ,銅$\mrm{Cu}$を浸ける
- 導線で亜鉛$\mrm{Zn}$と銅$\mrm{Cu}$を結ぶ
と完成です.
電極はボルタ電池と同じく,イオン化傾向から亜鉛$\mrm{Zn}$の方が陽イオンになりやすいので,ダニエル電池でも亜鉛$\mrm{Zn}$が陽イオンとなって溶液中へ溶け出します.
つまり,ダニエル電池を電池式は
となります.溶液が2種類あることに注意してください.
電極での反応
ダニエル電池の負極の亜鉛$\mrm{Zn}$側での反応は,ボルタ電池と同じく
となっています.
一方,正極の銅$\mrm{Cu}$側の溶液は硫酸銅水溶液$\mrm{CuSO_4}aq$で,水素イオン$\mrm{H^+}$がほとんど存在していないのでボルタ電池とは違って水素$\mrm{H_2}$が発生せず,以下の反応が起こります.
ダニエル電池では$\mrm{Cu}$電極で銅$\mrm{Cu}$が析出しているので,$\mrm{Cu}$電極はどんどん太っていきます.
ボルタ電池からの改善点
ボルタ電池では「電池の分極」が起こるために,電池としてはあまり優秀ではないのでした.確認のため,ボルタ電池での「電池の分極」の原因をもう一度挙げましょう.
- 銅$\mrm{Cu}$の表面に発生した水素$\mrm{H_2}$が電子$\mrm{e^-}$と水素イオン$\mrm{H^+}$の反応を阻害する
- 水素$\mrm{H_2}$が発生しすぎて逆反応$\mrm{H_2 \to 2H^+ + 2e^-}$が起こってしまい,電子$\mrm{e^-}$が逆流する
- 亜鉛$\mrm{Zn}$付近に発生した亜鉛イオン$\mrm{Zn^{2+}}$が濃くなりすぎて,亜鉛$\mrm{Zn}$のイオン化が阻害される
水素が発生しない
ボルタ電池の正極$\mrm{Cu}$で発生していた水素$\mrm{H_2}$が,ダニエル電池では発生しなくなります.
ボルタ電池の溶液は酸性の希硫酸$\mrm{H_2SO_4}aq$で,溶液中にたくさん水素イオン$\mrm{H^+}$が存在しているのでした.
一方,ダニエル電池の溶液中にはほとんど水素イオン$\mrm{H^+}$が存在しないので,水素$\mrm{H_2}$が発生しないというわけですね.
これだけでボルタ電池の分極が起こる原因の1と2が改善されています.
溶液中は電気的に中性
溶液の基本として「溶液は必ず電気的に中性である」というものがあります.つまり,一つの溶液の中にプラスイオンだけが多くあったり,マイナスイオンだけが多くあったりはしません.
ダニエル電池では反応が起こると,
- 硫酸亜鉛水溶液$\mrm{ZnSO_4}aq$中に$\mrm{Zn^{2+}}$が生じ,電気的にプラスに偏る
- 硫酸銅水溶液$\mrm{CuSO_4}aq$中から$\mrm{Cu^{2+}}$がなくなり,電気的にマイナスに偏る
となってしまい,そのままでは電気的中性は保たれませんが,ここで素焼き板はイオンは通すという性質がポイントになります.
硫酸亜鉛水溶液$\mrm{ZnSO_4}aq$がプラスに偏りそうになると,素焼き板を通して亜鉛イオン$\mrm{Zn^{2+}}$が硫酸銅水溶液$\mrm{CuSO_4}aq$に逃げていきます.
一方,硫酸銅水溶液$\mrm{CuSO_4}aq$がマイナスに偏りそうになると,素焼き板を通して硫酸イオン$\mrm{SO_4^{2-}}$が硫酸亜鉛水溶液$\mrm{ZnSO_4}aq$に逃げていきます.
このように,反応が進んでも素焼き板を通してイオンのみが移動することにより,各溶液は電気的に中性が保たれるわけです.
これにより,$\mrm{Zn}$電極付近の亜鉛イオン$\mrm{Zn^{2+}}$濃度が高くなるということがなくなます.
以上の理由から,ボルタ電池の分極が起こる原因が解消され,ダニエル電池では分極がほとんど起こらなくなるわけですね.

コメント