熱を加えて物質が分解する熱分解のように,電池に繋いでビリビリと電気を流すことで分解が起こる化学反応を電気分解というのでした.
また,電気分解において
というのでした.
今回の記事では,電気分解における
- 陽極の2パターンの反応
- 陰極の2パターンの反応
の全4パターンをそれぞれ解説します.
「電池と電気分解」の一連の記事
陽極の反応の2つのパターン
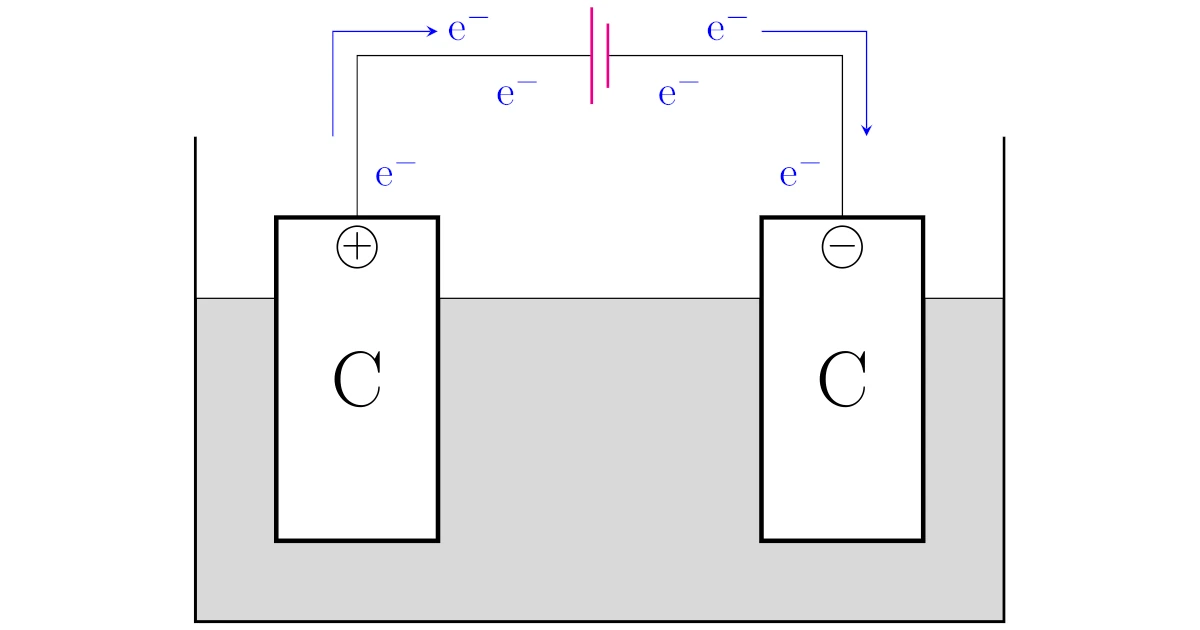
まず陽極とは電池の正極と繋がっている方の電気分解の極だったことを思い出しておきましょう(下図の$+$側の電極).
結論から言えば,陽極での反応は陽極の素材によって
- 電極が金$\mrm{Au}$・白金$\mrm{Pt}$・炭素$\mrm{C}$でないとき,電極が陽イオンになって溶ける.
- 電極が金$\mrm{Au}$・白金$\mrm{Pt}$・炭素$\mrm{C}$のとき,
- 溶液中にハロゲンが含まれていれば,酸化されてハロゲンが生じる.
- 溶液中にハロゲンが含まれていなければ,酸素$\mrm{O_2}$が生じる.
となります.
陽極が金$\mrm{Au}$・白金$\mrm{Pt}$・炭素$\mrm{C}$でないとき
陽極が金$\mrm{Au}$・白金$\mrm{Pt}$・炭素$\mrm{C}$のいずれでもなければ,電極が酸化されて陽イオンとなって溶け出します.
つまり,金$\mrm{Au}$・白金$\mrm{Pt}$・炭素$\mrm{C}$くらいイオン化傾向が小さく陽イオンになりにくい素材でなければ,電極自体から電子$\mrm{e^-}$が抜かれ陽イオンにされるわけですね.
金$\mrm{Au}$・白金$\mrm{Pt}$・炭素$\mrm{C}$は「高級なもの」と考えれば覚えやすいです.金$\mrm{Au}$も白金(プラチナ)$\mrm{Pt}$も高級品で,炭素$\mrm{C}$はダイヤモンド$\mrm{C}$からの連想です.
たとえば,陽極に銅$\mrm{Cu}$を用いると,
\begin{align*}\mrm{Cu \to Cu^{2+} + 2e^-}\end{align*}
の反応が起こります.他にも,陽極に亜鉛$\mrm{Zn}$を用いると,
\begin{align*}\mrm{Zn \to Zn^{2+} + 2e^-}\end{align*}
の反応が起こります.
陽極が金$\mrm{Au}$・白金$\mrm{Pt}$・炭素$\mrm{C}$のとき
陽極が金$\mrm{Au}$・白金$\mrm{Pt}$・炭素$\mrm{C}$のいずれかならば,溶液に含まれているイオンが酸化されます.
つまり,金$\mrm{Au}$・白金$\mrm{Pt}$・炭素$\mrm{C}$くらいイオン化傾向が小さく陽イオンになりにくい素材であれば,溶液から電子$\mrm{e^-}$が抜かれるわけですね.
さらに,溶液に含まれているイオンに「ハロゲン化物イオン($\mrm{Cl^-}$・$\mrm{I^-}$など)が含まれているかどうか」で反応が分かれます.
溶液にハロゲン化物イオンが含まれているとき
ハロゲン化物イオンはとても酸化されやすいので,溶液中にハロゲン化物イオンが含まれている場合にはハロゲン化物イオンが酸化されます.
たとえば,溶液中に塩化物イオン$\mrm{Cl^-}$が含まれていれば,
\begin{align*}\mrm{2Cl^- \to Cl_2 + 2e^-}\end{align*}
の反応が起こりますし,ヨウ化物イオン$\mrm{I^-}$が含まれていれば,
\begin{align*}\mrm{2I^- \to I_2 + 2e^-}\end{align*}
の反応が起こります.
溶液に酸化されにくいイオンしか含まれていないとき
ハロゲン化物イオンのような酸化されやすいイオンが含まれていないときは,酸素$\mrm{O_2}$が発生します.
酸化されにくいイオンは,たとえば
- 硝酸イオン$\ce{NO3^-}$
- 硫酸イオン$\ce{SO4^2-}$
- リン酸イオン$\ce{PO4^3-}$
などのことです.
これらが酸化されにくい理由は,それぞれに含まれる窒素$\mrm{N}$・硫黄$\mrm{S}$・リン$\mrm{P}$の酸化数が高く,それ以上酸化できないことにあります.
化合物中のそれ以上酸化できないような元素は「最高酸化数に達している」などと言います.
このときの半反応式は
- 溶液が強塩基でない場合\begin{align*}\mrm{2H_2O \to O_2 + 4H^+ + 4e^-}\end{align*}
- 溶液が強塩基の場合\begin{align*}\mrm{4OH^- \to O_2 + 2H_2O + 4e^-}\end{align*}
と溶液の塩基性の強さにより半反応式は異なりますが,どちらの反応でも酸素$\mrm{O_2}$が発生します.
強塩基の場合は,水酸化物イオン$\ce{OH-}$が溶液中に多量に存在し,水酸化物イオン$\mrm{OH^-}$は酸化されやすいので,$\mrm{OH^-}$から酸素$\mrm{O_2}$が発生します.
一方,強塩基でない場合は,$\mrm{OH^-}$が溶液中に少ないので,水$\mrm{H_2O}$から酸素$\mrm{O_2}$が発生します.
陰極の反応の2つのパターン
次に陰極とは電池の負極と繋がっている方の電気分解の極だったことを思い出しておきましょう(下図の$-$側の電極).
結論から言えば,陰極での反応は溶液中の金属のイオンのイオン化傾向の強さによって
- 溶液中にイオン化傾向の小さい金属のイオン($\mrm{Cu^{2+}}$, $\mrm{Ag^+}$など)が含まれているとき,これらは還元されて析出する($\mrm{Cu}$, $\mrm{Ag}$などが生じる).
- 溶液中にイオン化傾向の小さい金属のイオン($\mrm{Cu^{2+}}$, $\mrm{Ag^+}$など)が含まれていないとき,水素$\mrm{H_2}$が生じる.
となります.
実は陰極の反応は微妙なところがあるのですが,高校化学ではそのような微妙な場合が出題されることはほとんどないので,この記事では典型的な内容のみ扱います.
溶液にイオン化傾向の小さい金属の陽イオンが含まれているとき
「イオン化傾向の小さい金属の陽イオン」は簡単に還元されて,単体の金属に戻ろうとします.
ここでの「イオン化傾向の小さい金属」として典型的なものとしては,銅$\mrm{Cu}$・銀$\mrm{Ag}$が挙げられます.
たとえば,溶液中に銅イオン$\mrm{Cu^{2+}}$が含まれていれば,
\begin{align*}\mrm{Cu^{2+} + 2e^- \to Cu}\end{align*}
の反応が起こりますし,溶液中に銀イオン$\mrm{Ag^+}$が含まれていれば,
\begin{align*}\mrm{Ag^+ + e^- \to Ag}\end{align*}
の反応が起こります.それぞれ単体の銅$\mrm{Cu}$,銀$\mrm{Ag}$が生成していることに注目してください.
このように,溶液中のイオンなどが固体となって生成されることを析出といいます.そのため,上の場合はそれぞれ「銅$\mrm{Cu}$が析出した」「銀$\mrm{Ag}$が析出した」などと表現します.
溶液にイオン化傾向の小さい金属の陽イオンが含まれていないとき
「イオン化傾向の大きい金属」は陽イオンでいる方が安定なので単体の金属に戻ろうとはせず,水素$\mrm{H_2}$が発生します.
「イオン化傾向の大きい金属の陽イオン」として典型的なものとしては,アルカリ金属・アルカリ土類金属・アルミニウム$\mrm{Al}$が挙げられます.
このときの半反応式は
- 強酸でない場合\begin{align*}\mrm{2H_2O + 2e^- \to H_2 + 2OH^-}\end{align*}
- 強酸の場合\begin{align*}\mrm{2H^+ + 2e^- \to H_2}\end{align*}
と溶液の酸性の強さにより半反応式は異なりますが,どちらの反応でも水素$\mrm{H_2}$が発生します.
強酸の場合は,水素イオン$\mrm{H^+}$が溶液中に多量に存在し,水素イオン$\mrm{H^+}$は還元されやすいので,$\mrm{H^+}$から水素$\mrm{H_2}$が発生します.
一方,強酸でない場合は,$\mrm{H^+}$が溶液中に少ないので,水$\mrm{H_2O}$から水素$\mrm{H_2}$が発生します.

コメント